
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость скорости реакции от природы реагирующих веществ
|
|
|
|
Влияние природы реагирующих веществ определяется их атомным составом, пространственным строением и свойствами молекул. Скорость реакции определяется скоростью разрыва одних химических связей и образования других. При этом изменяется потенциальная энергия реагирующих частиц и всей системы.
Для того, чтобы произошла реакция, необходимо преодолеть отталкивание электронных оболочек молекул, разорвать связи между атомами в молекулах исходных веществ. На это нужно затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение будет неэффективным и новые молекулы не образуются. Если молекулы обладают достаточной энергией, при их столкновении происходит перестройка атомов и образуются молекулы нового вещества. Такой запас энергии называется энергией активации данной реакции (Еа) измеряется в кДж/моль. Молекулы, обладающие такой энергией, называются активными молекулами.
Для различных реакций энергия активации различна. Именно этим и определяется влияние на скорость реакции природы реагирующих веществ. Если энергия активации очень мала, то большая часть столкновений будут эффективными и скорость такой реакции велика. Например, ионные реакции протекают практически мгновенно, так как обладают очень низкой Еа.
Реакции с очень большой энергией активации протекают очень медленно. Например, реакция синтеза аммиака при обычных температурах:
3 H2(г) + N2(г) = 2 NH3(г)
Реакции начинаются с того, что разрываются старые связи между атомами в молекулах исходных веществ. При этом вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом. Именно для его образования необходима энергия активация. Активированный комплекс неустойчив, существует очень короткое время. Он распадается с образованием исходных веществ или продуктов реакции, при этом выделяется энергия.
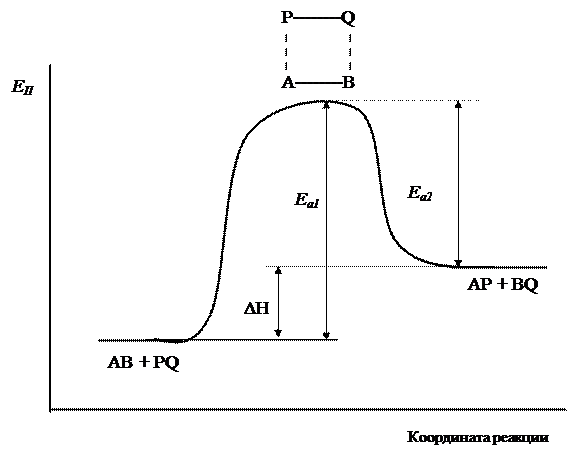 На рис.7 показано изменение потенциальной энергии системы при взаимодействии исходных веществ АВ и PQ. В ходе реакции образуется промежуточный активированный комплекс АВPQ. Энергия активации прямой реакции Еа1 определяется как разность между энергией активированного комплекса и потенциальной энергией исходных веществ. Энергия активации обратной реакции Еа2 равна разности энергии активированного комплекса и потенциальной энергией продуктов реакции. Очевидно, что тепловой эффект реакции ΔH определяется как разность энергий активации прямой и обратной реакций, или разность значений потенциальной энергии системы в начальном и конечном состоянии.
На рис.7 показано изменение потенциальной энергии системы при взаимодействии исходных веществ АВ и PQ. В ходе реакции образуется промежуточный активированный комплекс АВPQ. Энергия активации прямой реакции Еа1 определяется как разность между энергией активированного комплекса и потенциальной энергией исходных веществ. Энергия активации обратной реакции Еа2 равна разности энергии активированного комплекса и потенциальной энергией продуктов реакции. Очевидно, что тепловой эффект реакции ΔH определяется как разность энергий активации прямой и обратной реакций, или разность значений потенциальной энергии системы в начальном и конечном состоянии.
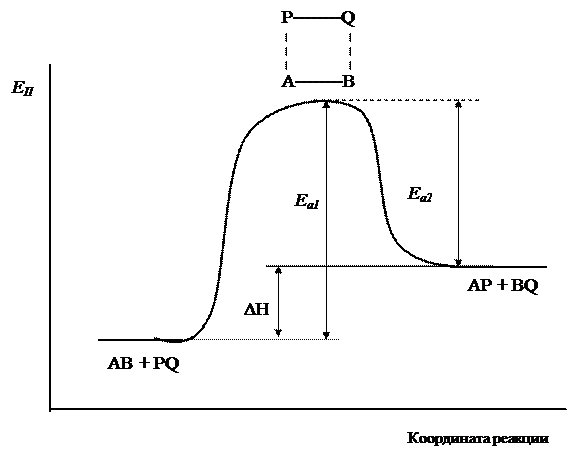 |
Рис.7. Изменение потенциальной энергии системы при взаимодействии веществ АВ и PQ
Пример №1: По энергетической диаграмме реакции А + Б = АБ определите тепловой эффект реакции Δ H и энергию активации Еа ..
 Решение. Потенциальная энергия исходных веществ (А + В) 100 кДж, продуктов реакции 200 кДж, энергия активированного комплекса 250 кДж. Энергия активации прямой реакции
Решение. Потенциальная энергия исходных веществ (А + В) 100 кДж, продуктов реакции 200 кДж, энергия активированного комплекса 250 кДж. Энергия активации прямой реакции
Еа .=(250-100)кДж=50 кДж.
Тепловой эффект реакции равен разности значений потенциальной энергии продуктов и исходных веществ: ΔH = (200 – 100) = 100кДж
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 3022; Нарушение авторских прав?; Мы поможем в написании вашей работы!