
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные законы химии
|
|
|
|
Атомно-молекулярное учение. Исключительное значение для развития химии имело атомно-молекулярное учение, колыбелью которого является Древняя Греция. Атомистика древнегреческих материалистов отделена от нас 25-ве-ковым периодом, однако логика греков поражает настолько, что философское учение о дискретном строении материи, развитое ими, невольно сливается в сознании с нашими сегодняшними представлениями.
Как же зародилась атомистика? Основным научным методом древнегреческих философов являлись дискуссия, спор. Для поиска “первопричин” в спорах обсуждались многие логические задачи, одной из которых являлась задача о камне: что произойдет если начать его дробить? Большинство философовсчитало, что этот процесс можно продолжать бесконечны. И только Левкип(500—440 до н. э.) и его школа утверждали, что этот процесс не бесконечен:при дроблении в конце концов получится такая частица, дальнейшее делениекоторой будет просто невозможно. Основываясь на этой концепции, Левкиппутверждал: материальный мир дискретен, он состоит из мельчайших частиц ипустоты. Ученик Левкиппа Демокрит (460—370 до н. э.) назвал мельчайшие частицы“неделимые”, что по-гречески значит “атом”. Это название мы используем исегодня. Демокрит, развил новое учение — “атомистику”, приписал атомамтакие “современные” свойства, как размер и форму, способность к движению.Последователь Демокрита Эпикур (342—270 до н. э.) придал древнегреческой атомистике завершенность, предположив, что у атомов существует внутренний источник движения и они сами способны взаимодействовать друг с другом.Все положения древнегреческой атомистики выглядят удивительно современно, и нам они, естественно, понятны. Ведь любой из нас, ссылаясь на опыт науки, может описать множество интересных экспериментов, подтверждающих справедливость любой из выдвинутых концепций. Но совершенно непонятны они были 20--25 веков назад, поскольку никаких экспериментальных доказательств, подтверждающих справедливость своих идей, древнегреческие атомисты представить не могли.Итак, хотя атомистика древних греков и выглядит удивительно современно, ни одно из ее положений в то время не было доказано. Следовательно” атомистика, развитая Левкипом, Демокритом и Эпикуром, была и остается просто догадкой, смелым предположением, философской концепцией, но подкрепленной практикой. Это привело к тому, что одна из гениальных догадок человеческого разума постепенно была предана забвению.Были и другие причины, из-за которых учение атомистов было надолго забыто. К сожалению, атомисты не оставили после себя систематических трудов, а отдельные записи споров и дискуссий, которые были сделаны, лишь с трудом позволяли составить правильное представление об учении в целом.Главное же заключается е том, что многие концепции атомистики были еретичны и официальная церковь не могла их поддерживать.Об учении атомистов не вспоминали почти 20 веков. И лишь в XVII в. идеи древнегреческих атомистов были возрождены благодаря работам французского философа Пьера Гассенди (1592—1655 гг.). Почти 20 лет он потратил; чтобы восстановить и собрать воедино забытые концепции древнегреческих философов, которые он подробно изложил в своих трудах “О жизни, нравах и учении Эпикура” и “Свод философии Эпикура”. Эти две книги, в которых воззрения древнегреческих материалистов впервые были изложены систематически, стали “учебником” для европейских ученых и философов. До этого единственным источником, дававшим информацию о воззрениях Демкрита -а э п и к у р а, была поэма римского поэта Лукреция “О природе вещей”.История науки знает немало удивительных совпадений. Вот одно из них:возрождение древнегреческой атомистики совпадает по времени с установлениеР. Бойлем (1627—1691 гг.) фундаментальной закономерности, описывающейизменения объема газа от его давления. Качественное объяснение фактом, наблюдаемых Бойлем, может дать только атомистика: если газ имеет дискретное строение, т. е. состоит из атомов и пустоты, то легкость его сжатия обусловлена сближением атомов в результате уменьшения свободного пространства между ними.Первая робкая попытка применения атомистики для объяснения количественно наблюдаемых явлений природы позволяет сделать два очень важных вывода:1. Превратившись из философской гипотезы в научную концепцию, атомистика может стать мощным инструментом, позволяющим давать единственно правильную трактовку самым разнообразным явлениям природы.2. Для скорейшего превращения атомистики из философской гипотезы в научную концепцию доказательство существования атомов необходимо прежде всего искать при изучении газов, а не жидких и твердых веществ, которыми до этого занимались химики.Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся исследованием газов. Тогда-то и последует каскад открытий простых веществ:водород, кислород, азот, хлор. А несколько позже газы помогут установить те законы, которые принято называть основными законами химии. Они и позволят сформулировать основные положения атомно-молекулярного учения: · Все вещества состоят из атомов. · Атомы каждого вида одинаковы между собой, но отличаются от атомов любого другого вида. · При взаимодействии атомов образуются молекулы: гомоядерные или гетероядерные. · При физических явлениях молекулы сохраняются; при химических – разрушаются; при химических реакциях атомы в отличии от молекул сохраняются. · Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества. Закон сохранения массы вещества Исключительное значение для химии имело установление закона сохранения массы, являющегося следствием всеобщего естественного закона сохранения материи и движения, сформулированного М.В.Ломоносовым (1711—1765 гг.) как всеобщий естественный закон в 1748 г. в письме к Д. Эйлеру: “Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимется, столько присовокупится к другому, ежели, где убудет несколько материи, то умножится в другом месте... Сей всеобщий закон простирается и в самые правила движения; ибо тело, движущее своей силой другое, столько же он у себя теряет, сколько сообщает другому, которое от него движение получает” (Ломоносов М. В. Труды по физике и химии.— М., 1951.—Т. II.-" С. 188).Это положение, высказанное в виде философской концепции. М. В. Ломоносов подтвердил экспериментально в 1756 г., повторив опыты Р. Боиля по прокаливанию металлов в запаянных стеклянных сосудах (ретортах).Русский ученый установил, что если сосуд, содержащий металл, взвесить до и после прокаливания, не вскрывая его, то масса остается без изменений. При нагревании же металла во вскрытой реторте масса увеличивается за счет его соединения с воздухом, проникающим в сосуд.Аналогичных выводы на основе экспериментом по прокаливанию металловсделал в 1777 г. и А. Лавуазье (1743--1794 гг.), который (после открытия и 1774 г. Д. Пристли кислорода) уже знал качественный и количественный состав воздуха.Современная формулировка закона сохранения массы вещества формулируется так: масса веществ, вступающих в реакцию, равна массе веществ, полученных в результате реакции. Данный закон имеет большое практическое и теоретическое значение, позволяет контролировать химические процессы. Зная количество исходных веществ реакции, всегда можно на основании этого закона вычислить количества продуктов, которые должны получиться.В 1905 году А. Эйнштейн показал, что между массой тела (m) и его энергией (Е) существует связь, выражаемая соотношением Е = m с2 где с – скорость света в вакууме, 2,997925 ∙108 м с-1 (или ≈ 300 000 км/с). Это уравнение Эйнштейна справедливо как для макроскопических тел, так и для частиц микромира (электронов, протонов). При химических реакциях всегда выделяется или поглощается энергия. Поэтому при учете массы веществ необходимо принимать во внимание прирост или убыль ее, отвечающие поглощению или выделению энергии при данной реакции. Однако из-за громадного значения величины с2 тем энергиям, которые выделяются или поглощаются при химических реакциях, отвечают очень малые массы, лежащие вне пределов возможности измерений. Поэтому при химических реакциях можно не принимать во внимание ту массу, которая приносится или уносится с энергией. Закон постоянства состава. Французский ученый Пруст в конце XVIII века тщательно изучал количественный состав многих сложных веществ. Он пришел к заключению, что всякое химическое соединение имеет постоянный состав и одни и те же свойства (1799). Эти представления получили признание только после победы Пруста в семилетнем споре с другим французским химиком - Бертолле, который, в противоположность Прусту, доказывал, что состав всякого сложного вещества может колебаться в зависимости от условий его образования и особенно от количества веществ, взятых для его получения.
Для подтверждения закона Пруст получил воду несколькими различными способами и выяснил, в каком весовом соотношении соединены водород и кислород в воде. Для любого из способов справедливо следующее соотношение:
на 2 весовые части H приходится 16 весовых частей O,
1 вес. ч. H - x вес. ч. О.
X = 16 ∙ 1/2 = весовых частей кислорода.
Была принята следующая формулировка закона постоянства состава: каждое химическое соединение имеет вполне определенный и постоянный состав независимо от способа его получения. Вещества, имеющие постоянный состав имеют молекулярную структуру и называются дальтонидами.
Закон кратных отношений. Если два элемента образуют друг с другомнесколько химических соединений, то на одну и ту же массу одного из нихприходятся такие массы другого, которые относятся между собой как простые целые числа (Д. Дальтон, 1803 г.). Д. Дальтон (1776—1844 гг.) в дальнейшем, используя открытый им закон кратных отношений, закон эквивалентов и закон постоянства состава, создал новую версию атомистической теории, основанную на количественных соотношениях, возникающих при взаимодействии между химическими элементами. Нетрудно убедиться, что закон кратных отношений представляет собой дальнейшее развитие закона эквивалентов, основанное на последовательном анализе рядов химических соединений, образующихся при взаимодействии друг с другом двух любых химических элементов. В простейшем случае указанный ряд может состоять из двух соединений. Например, при взаимодействии углерода и кислорода: образуются два соединения: оксид углерода (II) и оксид углерода (IV).Рассчитав массу кислорода, соединяющуюся с одним и тем же количеством углерода при образовании этих оксидов, мы получим, что на одну единицу массы углерода в диоксиде углерода приходится ровно в 2 раза больше кислорода, чем в оксиде углерода (II). Выдвигая новую версию атомистической теории, опирающуюся на основные химические законы, и отдавая дань уважения древнегреческим философам атомистам, Д. Дальтон сохранил предложенное ими название для мельчайших неделимых частиц материи — атом. Использование закона постоянства состава и закона кратных отношений позволило Д. Дальтону установить значения относительных атомных масс элементов, принимая за единичную — массу атома водорода. Так, атом Дальтона, обладающий конкретным материальным свойством — атомной массой, из отвлеченной модели превратился в конкретное химическое понятие. С введением в химию понятия “атомная масса” наука переходит на более высокую ступень своего развития.Вместе с тем атомистика Дальтона еще не свободна от недостатков: в нейнет места молекулам, а существуют только “сложные атомы ”. Открытия, сделанные гораздо позднее показали относительность закона постоянства состава и закона кратных отношений. Выяснилось, что соотношение между массами элементов, входящих в состав данного вещества, постоянно лишь при условии постоянства изотопного состава этих элементов. Например, тяжелая вода содержит 20% (масс.) водорода, а обычная вода лишь 11%. В начале 20 века Н.С.Курнаков, изучая сплавы металлов, открыл соелинения переменного состава. В этих соединениях на единицу массы данного элемента может приходится различная масса другого элемента. А позднее выяснилось, что соединения, не имеющие молекулярную структуру (атомную, ионную) имеют переменный состав, а следовательно к ним не применим закон кратных отношений. Такие соединения называют бертоллиды. Закон объемных отношений и закон Авогадро. Объемы вступающих в реакцию газов относятся друг к другу, а также к объему получающихся газообразных продуктов как простые целые числа (Ж. Гей-Люссак, 1805 г.). Этот закон находится в серьезном противоречии с выводами атомистики Дальтона.Для объяснения наблюдавшихся Ж. Гей-Люссаком закономерностей соединения газов оказалось необходимым предположить следующее: 1) любые газы (в том числе и простые) состоят не из атомов, а измолекул;2) в равных объемах различных газов при одинаковых температуре идавлении содержится одинаковое число молекул. Последнее утверждение, высказанное итальянским ученым А. А вогадро в1811 г., вошло в химию под именем закона Авогадро. Однако в начале XIX в.эти воззрения не получили должного признания: даже крупные химики тоговремени Д. Дальтон и И. Берцелиус отрицали возможность существованиямолекул, состоящих из нескольких одинаковых атомов. Прошло еще полвека,прежде чем на 1 Международном съезде химиков, состоявшемся в Карлсруэ(Германия) в сентябре 1860 г., были окончательно приняты основные химические представления (понятия об атомах и молекулах), зародившиеся в виде философского учения в Древней Греции (Левкипп, Демокрит, Эпикур), впервые развитые в виде научной концепции Д. Дальтоном, подтвержденные опытами Ж. Пруста, Ж. Гей-Люссака и окончательно сформулированные в трудах А.Авогадро и его ученика С.Канниццаро. Моль - это количеству вещества, содержащего столько же структурных частиц данного вещества, сколько атомов содержится визотопе углерода-12 массой 12 г. Для удобства расчетов, проводимых на основании химических реакций иучитывающих количества исходных реагентов и продуктов взаимодействия в молях, вводится молярная масса вещества. Молярная масса М вещества представляет собой отношение его массы кколичеству вещества: М =m/ V где m — масса в граммах, v — количество вещества в молях, М — молярнаямасса в г/моль — постоянная величина для каждого данного вещества.Значение молярной массы численно совпадает с относительной молекулярной массой вещества или относительной атомной массой элемента. Определение, данное молю, опирается на число структурных частиц, содержащихся в 12 г углерода. Было установлено, что указанная масса углерода содержит 6,02·1023 атомов этого элемента. Следовательно, любой химический индивид количеством 1 моль содержит 6,02·1023 структурных частиц (атомов или молекул). Число NA=6.02·1023 носит название постоянной Авогадро и выведено с использованием закона Авогадро.Из закона Авогадро следует, что два газа одинаковых объемов при одинаковых условиях, хотя и содержат одинаковое число молекул, имеют неодинаковые массы: масса одного газа во столько раз больше массы другого, во сколько раз относительная молекулярная масса первого больше, чем относительная молекулярная масса второго, т. е. плотности газов относятся как их относительные молекулярные массы. Д = m1/m2 , где m1 –масса данного газа, m2 – масса газа, по которому измеряется плотность, Д - относительная плотность газа.Независимая оценка значения молярной массы М может быть проведена наосновании обобщенного уравнения Клапейрона — Менделеева: PV = m · R · T/ MГде Р – давление газа в замкнутой системе, V – объем системы, m –масса газа, R – молярная газовая постоянная, равная 8,314 ДЖ/К·моль, Т – абсолютная температура.
Закон сохранения энергии. Закон сохранения энергии формулируется так: энергия не возникает вновь и не исчезает, она лишь переходит из одного вида в другой. Так, тепловая энергия может переходить в электрическую, в механическую и наоборот и т.д.
Различают следующие виды энергии: механическую, тепловую, магнитную, электрическую, лучистую, химическую (потенциальную) и др..
Химической называется энергия, которая находится в веществах в скрытом состоянии и освобождается только при химических реакциях. Непосредственно химическую энергию, содержащуюся в веществе, измерить нельзя, поэтому ее относят к потенциальной энергии. При химических реакциях происходит не только изменение состава взаимодействующих веществ, но также изменение энергии. Если получающиеся вещества содержат меньше химической энергии, чем исходные, то этот избыток превращается в эквивалентное количество энергии другой формы: механической, световой, тепловой, электрической. Количество тепла, которое выделяется или поглощается при образовании или разложении моля вещества, называется тепловым эффектом реакции и выражается в килокалориях (ккал).
Все виды энергии, в том числе и химическая, легче всего превращается в тепловую, поэтому при химических реакциях чаще всего наблюдается выделение или поглощение тепла.
Тепловой эффект реакции принято обозначать через Δ H и выражать в килокалориях (ккал) или в килоджоулях (кДж), и относить к 1 молю вещества. Знаки тепловых эффектов считаются отрицательными у экзотермических процессов (теплота выделяется) и положительными у эндотермических процессов (теплота поглощается).
Экзотермической называется реакция, протекающая с выделением энергии. Выделение энергии обозначают Δ H со знаком минус:
2H2 + O2 = 2H2O (Δ H = – 68,4 ккал\моль).В полученном при экзотермической реакции веществе энергии меньше, чем в исходных веществах. Экзотермические вещества устойчивы по отношению к нагреванию. Чем больше выделяется тепла при его образовании, тем труднее оно разлагается. Количество тепла, выделяющегося при образовании вещества, может служить мерой прочности вещества: сколько выделяется тепла при образовании вещества (воды), столько тепла нужно затратить, чтобы разложить вещество на составные части (водород и кислород), чтобы полученные вещества сохраняли прежний запас химической энергии.При образовании оксидов и сульфидов, как правило, выделяется много тепла, поэтому земная кора состоит из оксидов и сульфидов – веществ, устойчивых к нагреванию.Уравнения реакций, включающие, кроме формул веществ, тепловой эффект реакции, называются термохимическими. Приведенное выше уравнение реакции горения водорода термохимическое. Эндотермической называется реакция, протекающая с поглощением энергии, т.е. требующая нагревания. Знак теплового эффекта в эндотермической реакции положительный. Примером может служить реакция образования йодоводорода:
H2 + J2 = 2HJ(Δ H = + 6 ккал).В полученном при эндотермической реакции веществе энергии больше, чем в исходных. Эндотермические вещества неустойчивы к нагреванию, причем, чем больше энергии поглощается при образовании вещества, тем менее устойчиво вещество к нагреванию.Следствие из закона сохранения энергии: если реакция идет с выделением тепла, то обратный процесс пойдет с поглощением тепла:
a) 2H2O = 2H2 + O2 (Δ H = +68,4 ккал),
б) 2H2 + O2 = 2H2 (Δ H = -68,4 ккал). Закон эквивалентов. Химические элементы соединяются друг с другом встрого определенных количествах, соответствующих их эквивалентам (В.Рихтер, 1792—1794 гг.). Понятие эквивалента введено в химию для сопоставления соединительной способности различных элементов. Эквивалентомхимического элемента называют такую его массу, которая соединяется с 1,008 ч. м. (части массы) водорода или 8 ч. м. кислорода или замещает эти массы в соединениях. Отметим, что один и тот же элемент может иметь не один, а несколько эквивалентов. Так, эквивалент углерода в оксиде углерода (IV) равен трем, а в оксиде углерода (II) — шести.Понятие эквивалента можно распространить и на сложные соединения типакислот, солей и оснований. Эквивалентом сложного соединения называют массу этого соединения, содержащую эквивалент водорода (кислоты) или эквивалент металлической составной части (основания, соли).В общем виде закон эквивалентов можно сформулировать следующимобразом: во всех химических реакциях взаимодействие различных веществ друг с другом происходит в соответствии с их эквивалентами, независимо от того, являются ли эти вещества простыми или сложными.
Введение понятия «эквивалент» значительно упрощает некоторые расчеты в теоретических и практических задачах по химии.
Согласно современным рекомендациям эквивалент – это реальная частица, или условная единица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или 1 электрону в окислительно-восстановительных реакциях (О.С. Зайцев. Методика обучения химии. Учебник для студентов высших учебных заведений. 1999г.).
Эквивалент величина безразмерная, а его состав выражают с помощью знаков и формул:
Э(Х) = 1/z Х, где Х – формульная единица вещества; 1/z – фактор эквивалентности, а z – эквивалентное число, равное суммарному заряду ионов одного знака, обмениваемых структурной единицей вещества, или числу электронов, принимаемых или отдаваемых структурной единицей.
Для того, чтобы определить состав эквивалентов вещества и правильно записать его формулу необходимо исходить из конкретной реакции, в которой участвует данное вещество.
Например, в реакциях нейтрализации
1) КОН + Н3РО4 = КН2РО4 + Н2О
Э(Н3РО4) = 1 Н3РО4; Э(КОН) = 1 КОН; Э(КН2РО4) = 1 КН2РО4
2) 2КОН + Н3РО4 = К2НРО4 +2Н2О
Э(Н3РО4) = 1/2 Н3РО4; Э(КОН) = 1/2 КОН; Э(К2НРО4) = 1/2 К2НРО4
3) 3КОН + Н3РО4 = К3РО4 +3Н2О
Э(Н3РО4) = 1/3 Н3РО4; Э(КОН) = 1/3 КОН; Э(К3РО4) = 1/3 К3РО4
Т.е. Экислоты = 1/ число замещаемых в реакции ионов Н+.
Эоснования = 1/число замещаемых в реакции ОН-.
Эсоли = 1/число ионов Н+ или ОН-, участвующих в процессе.
В реакции окисления-восстановления
Эокислителя = 1/ число электронов, принятых одной
формульной единицей окислителя
Эвосстановителя = 1/ число электронов, отданных одной
формульной единицей восстановителя.
Например, в реакции
4) Мg + 2HCl = MgCl2 + H2
Э(Мg) = ½ Мg; Э(HCl) = 1(HCl); Э(MgCl2) = ½ MgCl2 ; Э(H2) = ½ H2
Поскольку эквивалент есть реальная или условная частица вещества, для него характерны понятия: количество вещества эквивалента и молярная масса эквивалента. Единицей количества вещества эквивалента является моль. 1 моль эквивалентов – это количество вещества, содержащего 6,02·1023 эквивалентов.
Массу одного моля эквивалентов называют молярной массой эквивалентов вещества МЭ(Х), г/моль.
Например, в рассмотренной реакции (4)
МЭ(Мg) = ½ · М(Мg) = ½ · 24 = 12 (г/моль); МЭ(HCl) = 1· М(HCl) = 36,5 (г/моль) МЭ(MgCl2) = ½ М(MgCl2) = ½ · 95 = 47,5 (г/моль);
МЭ(H2) = ½ · М(H2) = ½ · 2 = 1 (г/моль)
При расчете молярной массы эквивалентов вне конкретной реакции допускается использование следующих формул:
1) для элементов МЭ(Х) = М(Х)/В, где
М(Х) – молярная масса атома элемента (г/моль);
В – валентность элемента в данном химическом соединении.
2) для простого вещества МЭ(Х) = М(Х) / В, где
МЭ(Х) – молярная масса атома данного вещества (г/моль);
В – валентность атома
3) для сложного вещества МЭ(Х) = М(Х) / В · n, где
МЭ(Х) – молярная масса данного вещества (г/моль);
В – валентность функциональной группы
n – число функциональных групп в молекуле.
Для кислот функциональной группой является ион Н+, для оснований – ОН-, для солей – ион металла.
Для газов наряду с молярной массой эквивалента используется понятие молярный объем эквивалента.
Т.к. моль любого газа при н.у. (Т = 273К, Р = 101,3 кПа или 760мм рт. ст.) занимает объем, равный 22,4л, то объем одного моля эквивалентов газа при н.у. будет равен Vm (1/z X) = 1/z · 22,4 (л/моль)
Например, Э(Н2) = ½ Н2 Vm (½ Н2) = 22,4: 2 = 11,2 (л/моль).
Количественные отношения веществ в реакциях, выражаемые эквивалентами, определяет закон эквивалентов: в химической реакции вещества реагируют в равных количествах вещества эквивалентов веществ
n(1/z X1) = n (1/z X2) или n(Э(X1) = n (Э(X2)
Из этого следует, что
1) массы реагирующих в реакции веществ пропорциональны молярным массам их эквивалентов: m1 Mэ1
- --- = ----
m2 Mэ2
2) Объемы газов, участвующих в реакции относятся как молярные объемы их эквивалентов: V(X1) Vm (1/z1 X1)
- -------- = ------------------
V(X2) Vm (1/z2 X2)
3) Для веществ, находящихся в растворе, закон эквивалентов принимает следующий вид: Сэкв.(1) · V1 = Сэкв.(2) · V2, где
Сэкв.(1) и Сэкв.(2) – молярные концентрации эквивалентов растворов реагирующих веществ, моль/л или н.;
V1 и V 2 - объемы растворов реагирующих веществ, л.
Молярная концентрация эквивалента показывает число молей эквивалентов растворенного вещества, содержащегося в 1л раствора.
n(1/z X)
С(1/z X) = ------------ где,
V
С(1/z X) – молярная концентрация эквивалента, моль/л или н.;
n(1/z X) – число молей эквивалентов растворенного вещества, моль;
V – объем раствора вещества, л.
Раствор, содержащий 1 моль эквивалента вещества в 1л, называется нормальным раствором этого вещества. Допускается применение и десятичных долей нормальности растворов. Например, если в реакции
НСl + KOH = H2O + KOH
в 0,5л раствора соляной кислоты содержится 3,65 НСl, то
М (НСl) = 36,5 (г/моль); nЭ(НСl) = 3,65г: 36,5 г/моль = 0,1 моль
Сэкв(НСl ) = 0,1моль: 0,5л = 0,2 (моль/л) или 0,2н. НСl (f = 1)
Примеры решения типовых задач
Пример 1. В состав метана входит 75% углерода и 25% водорода. Определите молярную массу эквивалента углерода.
Решение. Указанное процентное содержание углерода и водорода обозначает, что в 100 весовых частях вещества содержится 75 весовых частей углерода и 25 весовых частей водорода. Следовательно, в метане углерод и водород соединены в весовом отношении 75:25. Это отношение должно равняться отношению их эквивалентов.
На 75 весовых частей С приходится 25 весовых частей Н
x вес. ч. С - 1 вес. ч. H.
Отсюда М(Эc) = 75 · 1/ 25 = 3 г/моль.
Пример 2. Определить молярную массу эквивалента магния, если 3 весовые части его присоединяют 2 весовые части кислорода.
Решение. Так как эквивалент кислорода всегда равен 8, можно написать 3 вес. ч. Mg присоединяют 2 вес. ч. О
x вес. ч. Mg - 8 вес. ч. О
М(ЭMg) = 3 · 8/ 2 = 12 г/моль.
Пример 3. Определить молярную массу эквивалента серной кислоты, если 2г магния реагируют без остатка с 8,17 г серной кислоты и молярная масса эквивалента магния равен 12г/моль.
Решение. Согласно закона эквивалентов
m (Mg): M (Э (Mg)) = m (H2SO4): M(Э(H2SO4)), откуда
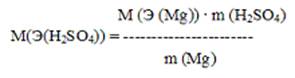
M(Э(H2SO4)) = 12г/моль · 8,17г: 2г = 49,02 (г/моль)
Пример 4. В стратосфере на высоте 20-30 км находится слой озона O3, защищающий Землю от мощного ультрафиолетового излучения Солнца. Если бы не "озоновый экран" в атмосфере, то фотоны с большой энергией достигли бы поверхности Земли и уничтожили на ней все живое. Подсчитано, что в среднем на каждого жителя Москвы в воздушном пространстве над городом (вплоть до верхней границы стратосферы) приходится по 150 моль озона. Сколько молекул O3 и какая масса озона приходится в среднем на одного москвича?
Решение. Запишем условие задачи в формульном виде:
n (O3) = 150 моль
M (O3) = 48 г/моль
N A = 6,02. 1023 моль--1
N (O3) =?
m (O3) =?
В решении задачи используется уравнение, связывающее между собой число частиц N (O3) в данной порции вещества n (O3) и число Авогадро N A, а именно:
n (O3) = N (O3) / N A;
отсюда:
N (O3) = n (O3). N A = 150. 6,02 . 1023 [моль. моль--1] =
= 9,03. 1025 m (O3) = n (O3). M (O3) = 150. 48 [моль . г/моль] =
= 7200 г = 7,2 кг
Ответ. В воздушном пространстве над городом на каждого москвича приходится 7,2 кг озона, или 9,03. 1025 молекул O3.
Пример 5. Масса одного литра азота при н.у. равна 1,251г. Вычислите плотность газа по воздуху и водороду.
Решение. М(Н2) = 2 г/моль; Мвоздуха = 29 г/моль
М = m ·Vm/V V = 1,251 · 22,4 / 1 = 28 г/моль
D N2/H2 = M N2/ M H2 = 28: 2 = 14
D H2/возд. = = M N2/ Mвозд = 28: 29 = 0,93
Ответ. Плотность азота по водороду = 14 и по воздуху = 0,93
Пример 6. Вычислите относительную молекулярную массу смеси с объемной долей метана 0,8 и о,2 кислорода, используя значения относительной плотности этих газов по водороду.
Решение. Молекулярную массу смеси газов можно рассматривать как среднеарифметическое молекулярных масс составных частей с учетом их объемных долей. Так как решение необходимо дать через относительную плотность по водороду, определяем ее у составных частей смеси.
Д СН4/Н2 = 18: 2 = 9; Д О2/Н2 = 32: 2 = 16
Д смеси = (8· 80 + 16 · 20): 100 = 9,6
М смеси = Д смеси · 2 = 9,6 · 2 = 19,2 г/моль
Ответ: молярная масса смеси 19,2 г/моль
Пример 7. Круговорот азота в природе включает: а) "биологическую фиксацию" при помощи клубеньковых бактерий и б) процессы окисления при атмосферных электрических разрядах. Во время грозы в воздухе образуется некоторое количество оксида азота неизвестного состава. Установлено, что абсолютная масса одной молекулы этого оксида азота составляет 4,99. 10--23 г. Определите, какова формула этого вещества.
Решение. Чтобы установить формулу оксида азота N X O Y, который получается во время грозы, достаточно узнать молярную массу этого соединения. Известные к настоящему времени оксиды азота состава N2O, NO, N2O3, NO2, N2O4 и N2O5 имеют молярные массы, равные соответственно 44, 30, 76, 46, 92 и 108 г/моль.
Запишем условие задачи в формульном виде:
M мол(N X O Y) = 4,99. 10--23 г
N A = 6,02. 1023 моль--1
M (N X O Y) =?
Запишем уравнение, связывающее между собой молярную массу оксида азота M (N X O Y), абсолютную массу молекул этого оксида M мол(N X O Y) и число Авогадро N A:
M (N X O Y) = M мол(N X O Y). N A = 4,99. 10--23. 6,02. 1023
[г. моль--1] = 30 г/моль
Молярная масса, равная 30 г/моль, отвечает монооксиду азота NO.
Ответ. Формула образовавшегося во время грозы оксида азота -- NO.
Пример 8. Определите объем оксида углерода (IV) н.у., а также массу хлорида кальция, образующихся при действии соляной кислоты на 10г карбоната кальция, с массовой долей примесей 20%.
Решение. М СаСО3 = 100г/моль
СаСО3 + 2 НСl = CaCl2 + CO2
1моль 1 моль 1 моль
100г 111г 22,4 л
1) Определяем массу примесей и количество известняка чистого:
m примесей = ω % · m CaCO3: 100 = 20 10: 100 = 2 г
m СаСО3 = 10 -2 = 8 г
n = m / M = 8: 100 = 0,08 моль СаСО3
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 1464; Нарушение авторских прав?; Мы поможем в написании вашей работы!