
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы Рауля и Вант-Гоффа
|
|
|
|
Растворимость твердых веществ в жидкостях
Взаимная растворимость жидкостей
Любую из жидкостей можно рассматривать в качестве растворителя. Поэтому часто используют понятие взаимной растворимости жидкостей. Например, можно говорить о растворимости эфира в воде и о растворимости воды в эфире. В зависимости от природы жидкости могут смешиваться в любых соотношениях (в этом случае говорят о неограниченной взаимной растворимости), быть практически нерастворимыми друг в друге, либо обладать ограниченной растворимостью. В случае ограниченной растворимости изменение температуры (повышение или понижение) приводит к увеличению концентрации каждого из растворов (увеличению взаимной растворимости), и при некоторой температуре, называемой критической температурой расслоения взаимная растворимость становится неограниченной.
Растворимость твердых веществ в жидкостях определяется природой веществ и, как правило, существенно зависит от температуры. Полярные растворители хорошо растворяют полярные вещества и плохо – неполярные, и наоборот.
Поскольку теплота растворения твердых веществ в жидкостях может быть как положительной, так и отрицательной, растворимость при увеличении температуры может увеличиваться либо уменьшаться (согласно принципу Ле Шателье – Брауна). В большинстве же случаев, растворимость твердых веществ увеличивается при повышении температуры.
Строение раствора определяется прежде всего характером компонентов, его образующих. Если компоненты близки по химическому строению, размерам молекул и т.п., то строение растворов принципиально не отличается от строения чистых жидкостей. Молекулы веществ, заметно отличающихся по своему строению и свойствам, обычно сильнее взаимодействуют друг с другом, что приводит к образованию комплексов в растворе, которые вызывают отклонения от идеальности. Энергии образования этих комплексов достигают величин нескольких кдж/моль, что позволяет говорить о существовании в растворах слабых химических взаимодействий и образовании тех или иных химических соединений — новых компонентов растворов. Взаимодействие с молекулами растворителя сопровождается у многих веществ (например, электролитов) обратным процессом — диссоциацией.
Растворы, компоненты которых близки по физическим и химическим свойствам (оптические изомеры, гомологи и т.п.) и образование которых не сопровождается объёмными и тепловыми эффектами называются идеальными. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Для идеальных растворов выполняется следующая закономерность, называемая первым законом Рауля:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
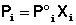
Поскольку сумма мольных долей всех компонентов раствора равна единице, для бинарного раствора, состоящего из компонентов А и В легко получить следующее соотношение, также являющееся формулировкой первого закона Рауля:
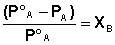
Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества.
Из первого закона Рауля следует, что п онижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества (второй закон Рауля ):


где K – криоскопическая постоянная растворителя – определяется природой растворителя; E - эбуллиоскопическая постоянная растворителя, не зависящая от природы растворенного вещества; m – моляльная концентрация раствора.
Законы Рауля и принцип Вант-Гоффа не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток – растворов электролитов. Обобщая экспериментальные данные, Вант-Гофф пришел к выводу, что растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания, осмотическое давление для них всегда больше, чем вычисленные. Для учета этих отклонений Вант-Гофф внес в уравнение для растворов электролитов поправку – изотонический коэффициент i:

Аналогичная поправка вносится в законы Рауля и изотонический коэффициент определяется следующим образом:
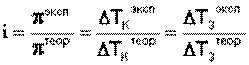
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Для объяснения особенностей свойств растворов электролитов С.Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах:
1. Электролиты под действием растворителя распадаются на положительные и отрицательно заряженные ионы.
2. Общий заряд катионов в растворе равен общему заряду анионов, поэтому раствор всегда электронейтрален.
3. Ионы и атомы одних и тех же элементов отличаются друг от друга по свойствам.
Например, атомы натрия реагируют с водой (щелочной металл), выделяя шелочь и газ Н2↑, тогда как ионы натрия Na+ c водой не реагируют. Хлор – газ, ядовитый, желто-зеленого цвета. Ионы хлора бесцветны, неядовиты, не имеют запаха (находятся в растворе поваренной соли). Атомы меди составляют свободную медь – металл красноватого цвета, а гидратированные ионы меди имеют синюю окраску (медный купорос CuSO4 ∙ 5H2O).
Для того, чтобы написать ион, справа вверху от знака атома элемента пишется величина и знак заряда. Например, атом натрия – Na, а ион натрия – Na+ (читается: "однозарядный катион натрия"); атом меди – Cu, а ион меди – Cu2+ (читается: "двухзарядный катион меди"); атом серы – S, ион серы – S2- (читается: "двухзарядный анион серы") и т. д.. Ионы, имеющие положительный заряд называются катионы, а ионы, имеющие отрицательный заряд – анионы.
Упражнение: Назовите (прочтите) следующие ионы: Fe2+, Fe3+, K+, Br-, Ca2+.
Э лектролитическая диссоциация – это распад электролитов на ионы при растворении в воде или расплавлении. Благодаря этому процессу растворы некоторых выществ проводят электрический ток.
М. Фарадей назвал вещества, водные растворы которых проводят электрический ток, электролитами. К их числу относятся щелочи, кислоты, соли растворимые.
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами (сахар, спирт, бензол и другие органические вещества).
Существует взаимосвязь между электропроводностью растворов и видом химической связи, по которому построены растворенное вещество и растворитель. Растворитель обязательно должен иметь ковалентную полярную связь. В неполярном растворителе (гексан, ацетон, бензол) диссоциации электролитов не происходит.
Если в воде растворено ионное соединение, например, хлорид натрия, кристаллическая решетка которого состоит из положительных ионов натрия Na+ и отрицательных ионов хлора Cl–, то в воде происходит следующий процесс:
· Молекула воды имеет ковалентную связь и представляет собой диполь ("ди" – два) Н+ОН-.
· При взаимодействии с ионами кристаллической решетки NaCl диполи воды ориентируются к положительным ионам своим отрицательным полюсом. Между ионами и диполями возрастают силы электростатического притяжения, которые "растаскивают" или расчленяют ионную кристаллическую решетку на отдельные ионы Na+ и Cl-, окруженные диполями воды, поэтому их называют гидратированными ионами.
Если же вещество растворенное имеет ковалентную полярную связь, например, HCl, то процесс идет иначе, но в растворе все же образуются гидратированные ионы. В полярном соединении, в отличие от ионного, нет готовых ионов. Они образуются в процессе растворения вещества в воде, в процессе взаимодействия их. Сначала происходит увеличение полярности молекул, а затем уже распад на ионы.
Если молекулы веществ построены по ковалентному неполярному виду связи, то при растворении их в воде ионы не образуются, т.к. неполярные молекулы не испытывают со стороны диполей воды такого воздействия, как молекулы ионные и полярные. По ковалентному неполярному виду построены молекулы большинства органических соединений.
Диссоциация электролитов в водных растворах
Вещества – электролиты это:
1. растворимые основания – щелочи,
2. кислоты,
3. растворимые соли.
Оксиды к электролитам не относятся, т. к. они не просто растворяются в воде, а вступают с ней в химическую реакцию, образуя гидроксид, который и диссоциирует.Нередко встречаются вещества, в молекулах которых наблюдается два вида связи. Например, в гидроксиде натрия – NaOH натрий связан с гидроксогруппой ионной связью, а водород с кислородом – ковалентной. В молекуле серной кислоты H2SO4 связь водорода с кислотным остатком более полярна, чем связь серы с кислородом. В нитрате алюминия Al(NO3)3 алюминий связан с кислотным остатком ионной связью, а атомы азота с атомами кислорода – ковалентной. В таких случаях распад молекулы на ионы происходит по месту ионной или наиболее полярной связи, для расщепления которых требуется меньше энергии.
Из сказанного следует, что ионы могут быть образованы не только из отдельных атомов, но и групп атомов. Например SO4 2- , NO3-, OH-.
Для количественной характеристики электролитической диссоциации вводится понятие степени диссоциации (a):
n
a = -----, где n – число молекул вешества, распавшихся на ионы;
N N – число молекул вещества, введенного в раствор.
В зависимости от степени диссоциации все электролиты условно делят на сильные (a =1) и слабые (a<1). Степень диссоциации зависит от природы электролита, температуры и концентрации раствора.
К сильным электролитам относятся: сильные минеральные кислоты НСl, H2SO4, HNO3, HMnO4 и др., гидроксиды щелочных и щелочно-земельных металлов, и все растворимые соли.
К слабым электролитам относятся: практически все органические вещества, слабые кислоты H2CO3, H2S, HNO2, H2SiO3, H3PO4, оставшиеся основания, и многие бинарные соединения Н2О, оксиды и др.
При написании уравнений электролитической диссоциации необходимо учитывать, что:
диссоциация многоосновных кислот и многокислотных оснований происходит ступенчато;
уравнение диссоциации сильных электролитов по первой ступени записывают, как необратимый процесс, а по всем последующим – как обратимый (исключение гидроксиды щелочных и щелочно-земельных металлов).
Например, HNO3 ® H+ + NO3- Ba(OH)2 ® Ba2+ + 2OH-
H2SO4® H+ + HSO4 - NH4H2PO4 ®NH4+ + H2PO42-
HSO4- «H+ + SO4 2- H2PO4- «H+ + HPO42-
K2CO3 ® 2K+ + CO3 HPO42- «H+ + PO43-
слабые электролиты диссоциируют обратимо по всем ступеням:
H2CO3 «H+ + HCO3- Pb(OH)2 «PbOH+ + OH-
HCO3- «H+ + CO32- PbOH+ «Pb2+ + OH-
Амфотерные гидроксиды являются слабыми электролитами и диссоциируют как по типу основания, так и по типу кислоты:
Zn(OH)2 «ZnOH+ +OH- Zn(OH)2 + H2O «H+ +H[Zn(OH)4]-
ZnOH+ «Zn2+ + OH- H[Zn(OH)4]- «H+ + [Zn(OH)4]2-
Для характеристики слабых электролитов применяют величину, называемую константой диссоциации.
Например,
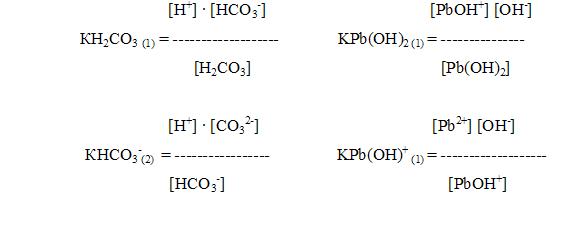
Константа диссоциации и степень диссоциации находятся в математической зависимости (закон разбавления): с уменьшением концентрации раствора (С) степень диссоциации (a) электролита возрастает.
Кд. = С · a2
Из закона разбавления могут быть получены формулы, связывающие константу диссоциации слабого электролита, степень диссоциации и концентрацию иона (Сиона). Действительно, так как
К = (СКt CAn) / C и CKt = CAn, то Сиона = Ö К/С.
Нетрудно видеть, что также Сиона = a С и Сиона = К/С.
П р и м е р 1. Вычислить степень диссоциации 0,2 М раствора муравьинной кислоты НСООН, если Кдисс = 2,1 · 10 -4.
Р е ш е н и е. По закону разбавления
a = Ö К/С = Ö (2,1 · 10-4) / 0,2 = 3,24 · 10-2, или 3,24%.
П р и м е р 2. Вычислить концентрацию водородных ионов [Н+] в 0,2 М растворе муравьиной кислоты.
Р е ш е н и е. Из предыдущей задачи a = 3,24 ·10-2, отсюда
Сиона = a С = 3,24 · 10-2 · 0,2 = 6,4 · 10-3 г-ион/л.
Уравнения ионных реакций
Согласно теории электролитической диссоциации суть реакций в растворах электролитов сводится к взаимодействию между ионами растворенных веществ. А это возможно, только если образующееся вещество трудно растворимо или является слабым электролитом. Иначе реакция будет обратима.
Например, 1) KCl + NaI «KI + NaCl
K++ Cl- + Na++ I- «K++ I- + Na+ + Cl-
2) 2AgNO3 + BaCl2 =BaNO3 + AgCl¯
2Ag+ + NO3- + Ba2+ + 2Cl- = Ba2+ + NO3- + AgCl¯
Ag++ Cl- = AgCl¯
3) KOH + HCl = KCl + H2O
K+ + OH- + H+ + Cl- = K+ + Cl- + H2O
OH- + H+ = H2O
Растворимость веществ указывается в таблице растворимости кислот, оснований и солей в воде.
Таблица 1- Таблица растворимости некоторых оснований и солей в воде
| ОН- | Cl- | S2- | SO32- | SO42- | PO43- | CO32- | PO3- | NO3- | CH3COOH- | SiO32- | |
| K+ | р | р | р | р | р | р | р | р | р | р | р |
| Na+ | р | р | р | р | р | р | р | р | р | р | р |
| Ba2+ | р | р | р | н | н | н | н | н | р | р | Н |
| Ca2+ | м | р | м | н | м | н | н | н | р | р | н |
| Mg2+ | м | р | р | н | р | н | н | н | р | р | н |
| Al3+ | н | р | - | - | р | н | - | н | р | м | н |
| Cr3+ | н | р | - | - | р | н | - | н | р | р | н |
| Fe2+ | н | р | н | н | р | н | н | н | р | р | н |
| Fe3+ | н | р | - | - | р | н | н | н | р | р | н |
| Mn2+ | н | р | н | н | р | н | н | н | р | р | н |
| Zn2+ | н | р | н | н | р | н | н | н | р | р | н |
| Ag+ | - | н | н | н | м | н | н | н | р | р | н |
| Hg+ | - | н | н | н | м | н | н | - | р | м | - |
| Hg2+ | - | р | н | н | р | н | н | - | р | р | - |
| Cu2+ | н | р | н | н | р | н | н | н | р | р | н |
| Pb2+ | н | м | н | н | н | н | н | н | р | р | н |
| Bi2+ | н | - | н | н | р | н | н | - | р | р | н |
| Sn2+ | н | р | н | - | р | н | - | - | - | р | - |
| NH4+ | р | р | р | р | р | р | р | - | р | р | - |
Примечание. «р» – растворимое в воде соединение;
«н» - нерастворимое в воде соединение;
«м» - малорастворимое в воде соединение;
«-» - соединение или не существует или разлагается водой.
Примечание. Для определения растворимости того или иного соединения надо найти в верхней строчке обозначение соответствующего катиона, а в левом столбце – аниона, провести от катиона вниз вертикальную линию, а от аниона
Памятка по составлению ионных уравнений
1. После составления молекулярного уравнения пишут в ионном виде формулы исходных веществ (только электролитов) – в левой части уравнения.
2. В правой части уравнения пишут в ионном виде формулы полученных веществ (тех, которые диссоциируют).
3. Проверяют, совпадают ли друг с другом по абсолютной величине общее число положительных и отрицательных зарядов ионов в левой части равенства, а затем в правой.
4. Проверяют, совпадает ли число одноименных ионов в левой и правой частях равенства (учитывая атомы, входящие в состав недиссоциированных молекул).
5. Находят в левой и правой частях ионного уравнения подобные члены с одинаковыми знаками и исключают их из уравнения, а затем записывают полученное сокращенное ионное уравнение, которое выражает сущность реакции.
Задания для контроля усвоения темы
1) Составьте молекулярные, полные ионные и сокращенные ионные уравнения следующих реакций:
1. хлорид железа (III) + гидроксид натрия,
2. сульфид натрия + соляная кислота,
3. гидроксид кальция + азотная кислота,
4. нитрат бария + сульфат алюминия,
5. сульфит калия + серная кислота,
6. фосфат натрия + нитрат серебра.
2) Cреди перечисленных реакций, укажите те, которые не протекают и почему:
1. сульфат натрия + хлорид меди (II),
2. нитрат цинка + гидроксид калия,
3. сульфат магния + нитрат натрия,
4. хлорид магния + гидроксид натрия,
5. гидрокарбонат калия + соляная кислота.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 9044; Нарушение авторских прав?; Мы поможем в написании вашей работы!