
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовые числа. Квантовые числа, возникающие при решении волнового уравнения, служат для описания состояний квантово-химической системы
|
|
|
|
Квантовые числа, возникающие при решении волнового уравнения, служат для описания состояний квантово-химической системы. Каждая атомная орбиталь характеризуется набором из трех квантовых чисел: главного n, орбитального l и магнитного ml.
Главное квантовое число n характеризует энергию атомной орбитали. Оно может принимать любые положительные целочисленные значения. Чем больше значение n, тем выше энергия и больше размер орбитали. Решение уравнения Шрёдингера для атома водорода дает следующее выражение для энергии электрона:
E = −2π2 me 4 / n 2 h 2 = −1312,1 / n 2 (кДж/моль)
Таким образом, каждому значению главного квантового числа отвечает определенное значение энергии электрона. Уровни энергии с определенными значениями n иногда обозначают буквами K, L, M, N... (для n = 1, 2, 3, 4...).
Орбитальное квантовое число l характеризует энергетический подуровень. Атомные орбитали с разными орбитальными квантовыми числами различаются энергией и формой. Для каждого n разрешены целочисленные значения l от 0 до (n −1). Значения l = 0, 1, 2, 3... соответствуют энергетическим подуровням s, p, d, f.
 рисунок 6
рисунок 6
Форма s -орбиталей сферическая, p -орбитали напоминают гантели, d - и f -орбитали имеют более сложную форму.
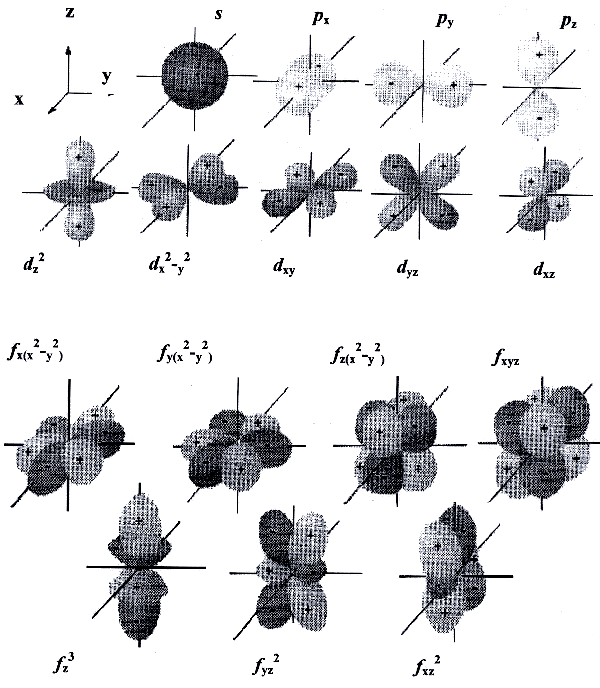
рисунок 7
Магнитное квантовое число ml отвечает за ориентацию атомных орбиталей в пространстве. Для каждого значения l магнитное квантовое число ml может принимать целочисленные значения от −l до +l (всего 2 l + 1 значений). Например, р -орбитали (l = 1) могут быть ориентированы тремя способами (ml = -1, 0, +1).
Электрон, занимающий определенную орбиталь, характеризуется тремя квантовыми числами, описывающими эту орбиталь и четвертым квантовым числом (спиновым) ms, которое характеризует спин электрона - одно из свойств (наряду с массой и зарядом) этой элементарной частицы. Спин - собственный магнитный момент количества движения элементарной частицы. Хотя это слово по-английски означает " вращение ", спин не связан с каким-либо перемещением частицы, а имеет квантовую природу. Спин электрона характеризуется спиновым квантовым числом ms, которое может быть равно +1/2 и −1/2.
Квантовые числа для электрона в атоме:
| главное квантовое число | n |
| орбитальное квантовое число | l |
| магнитное квантовое число | ml |
| спиновое квантовое число | ms |
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 597; Нарушение авторских прав?; Мы поможем в написании вашей работы!