
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 2. Возможна ли в стандартных условиях реакция
|
|
|
|
Возможна ли в стандартных условиях реакция
4HCl + O2 = 2H2O + 2Cl2?
Решение.
Для процессов, протекающих в природе самопроизвольно, характерно стремление к минимуму энергии, т. е. понижение энтальпии и стремление перейти в наиболее вероятное состояние с максимально допустимой в данных условиях степенью беспорядка, т. е. повышение энтропии.
Для реакций, протекающих при постоянном давлении и температуре, введена термодинамическая функция DG - энергия Гиббса (изобарно-изотермический потенциал), определяющая влияние энтальпии и энтропии на ход реакции. Энергия Гиббса является функцией состояния и расчет ее ведут по формулам:
DG0х.р. = DH0х.р. - T DS0х.р., (1)
DG0х.р. = 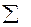 n DG0продукт. -
n DG0продукт. - 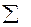 n DG0исх. веществ. (2)
n DG0исх. веществ. (2)
По знаку и величине энергии Гиббса можно судить о направлении реакции. Если DG0 < 0, возможно самопроизвольное протекание реакции в прямом направлении; если DG0 = 0, то в системе наступает состояние равновесия.
Чтобы ответить на вопрос, поставленный в условии задачи, необходимо рассчитать энергию Гиббса реакции горения хлороводорода. Выпишем из справочных таблиц [1] необходимые данные:
Вещество HCl (Г) O2 (Г) CI2 (Г) H2O (Г),
DH0, кДж/моль -92,31 0 0 -241,83,
S0, Дж/моль ´ К -186,68 205,03 222,95 188,72,
DH0х.р. = [2DH0(H2O) + 2DH0(Cl2)] - [4DH0(HCl) + DH0(O2)] =
= [(2 ´ (-241,83) + 2 ´ 0] - [4 ´ (-92,31) + 0] = -112 кДж,
DS0х.р. = [2 ´ S0(H2O) + 2S0(Cl2)] - [4S0(HCl) + 3S0(O2)] =
= (2 ´ 188,72 + 2 ´ 222,95) - (4 ´ 186,68 + 205,03) = -130 Дж/моль´K =
= -0,13 кДж/моль´К,
DG0х.р. = DH0х.р - TDS0х.р.,
DG0х.р. = (-112) - 298 ´ (-0,13) = -73,36 кДж/моль.
Энергия Гиббса химической реакции меньше нуля, следовательно, в стандартных условиях эта реакция возможна.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1953; Нарушение авторских прав?; Мы поможем в написании вашей работы!