
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 1. Как изменится скорость реакции образования аммиака N2 + 3H2 D 2NH3, если увеличить давление в системе в два раза и увеличить объем газовой смеси в три раза?
|
|
|
|
Как изменится скорость реакции образования аммиака N2 + 3H2 D 2NH3, если увеличить давление в системе в два раза и увеличить объем газовой смеси в три раза?
Решение.
Для того чтобы началась химическая реакция, необходимо выполнение условия DG < 0. Это условие необходимо, но недостаточно. Оно указывает на то, что нет энергетического запрета на протекание реакции, однако скорость ее может быть настолько мала, что реакция практически не идет.
Раздел химии, изучающий закономерности протекания химических реакций, называется химической кинетикой. Скорость химической реакции - это изменение концентрации реагирующих веществ (или продуктов реакции) в единицу времени в единице объема:
V =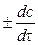 .
.
По условию задачи меняется объем и давление в системе, которые тесно связаны с изменением концентрации компонентов реакции. Зависимость скорости реакции от концентрации реагирующих веществ выражает закон действующих масс (з.д.м.): «При постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные коэффициентам реакции». Аналитическая запись закона для реакции в общем виде следующая:
aA + bB D cC + dD,
V = k[A]a ´ [B]b,
где k - константа скорости реакции, равная скорости реакции при концентрации компонентов равной единице. Запишем уравнение реакции и по закону действующих масс выразим скорость реакции:
N2 +3H2 D 2NH3,
V = k[N2] ´ [H2]3.
Чтобы увеличить давление в системе в два раза, можно в два раза уменьшить объем, при этом во столько же раз увеличится концентрация каждого компонента и скорость реакции в этих случаях будет представлена формулой
V' = k' [2N2] ´ [2H2]3 = k' ´ 16 [N2][H2]3.
Найдем отношение скоростей реакций до и после увеличения давления:
V'/V = k' ´ 16 [N2][H2]3 / k[N2] ´ [H2]3 = 16.
Таким образом, при увеличении давления в два раза скорость реакции увеличится в 16 раз.
Увеличение объема газовой смеси в три раза равносильно уменьшению концентрации компонентов во столько же раз, и скорость реакции будет представлена формулой
V' = k' [N2/3][H2/3]3 = k' ´ 1/81 ´ [N2][H2]3.
Найдем отношение скоростей до и после увеличения объема:
V'/V = k' ´ 1 ´ [N2][H2]3 / k ´ 81 ´ [N2] ´ [H2]3 = 1/81.
Итак, при увеличении объема газовой смеси в три раза, скорость химической реакции уменьшится в 81 раз.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1128; Нарушение авторских прав?; Мы поможем в написании вашей работы!