
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 3. Вычислите температуры кристаллизации и кипения 5 %-ного раствора сахара C12H22O11
|
|
|
|
Пример 2.
Пример 1.
Вычислите температуры кристаллизации и кипения 5 %-ного раствора сахара C12H22O11.
Решение.
При растворении в растворителе нелетучего вещества давление пара растворителя над раствором уменьшается, что вызывает повышение температуры кипения раствора и понижение температуры его замерзания по сравнению с чистым растворителем. При этом, согласно закону Рауля, повышение температуры кипения (Dtкип.) и понижение температуры замерзания (Dtзам.) раствора пропорционально молярной концентрации раствора:
Dtкип = E ´ Cm, (1)
Dtзам = К ´ Сm. (2)
Здесь Cm - молярная концентрация раствора (число молей растворенного вещества в 1000 г растворителя); E - эбуллиоскопическая константа растворителя, град; К - криоскопическая константа растворителя, град.
Так как молярная концентрация Cm = m ´ 1000 / M ´ m1,
где m - масса растворенного вещества, г; M - молекулярная масса растворенного вещества, г; m1 - масса растворителя, г, то формулы (1) и (2) можно записать следующим образом:
Dtкип = E ´ (m ´ 1000/M ´ m1), (3)
Dtзам = К ´ (m ´ 1000/M ´ m1). (4)
Эти формулы позволяют определить температуры замерзания и кипения растворов по их концентрации, а также находить молекулярную массу растворенного вещества по понижению температуры замерзания и повышению температуры кипения раствора.
Для воды криоскопическая константа (К) и эбуллиоскопическая константа (Е) соответственно равны 1,86 и 0,52 град. Молекулярная масса сахара 342 г. Рассчитаем понижение температуры кристаллизации 5 %-ного раствора сахара:
Dtзам = 1,86 ´ 5 ´ 1000 / 342 ´ 95 = 0,29 °С.
Вода кристаллизуется при 0 °С, следовательно, температура кристал-лизации раствора будет 0 - 0,29 = - 0,29 °С.
Из формулы (3) рассчитываем повышение температуры кипения этого раствора:
Dtкип = 0,52 ´ 5 ´ 1000 / 342 ´ 95 = 0,06 °С.
Вода кипит при 100 °С. Следовательно, температура кипения этого раствора будет 100 + 0,06 = 100,06 °С.
Рассчитайте, при какой температуре будет кристаллизоваться раствор, содержащий в 200 г бензола, 12 г нафталина?
Решение.
Криоскопическая константа бензола равна 5,10 град. Молекулярная масса нафталина C10H8 = 128 г. Из формулы (4) понижение температуры замерзания этого раствора
Dtзам = 5,10 ´ 12 ´ 1000 / 128 ´ 200 = 2,38 °С.
Бензол кристаллизуется при 5,53 °С. Таким образом, температура крис-таллизации раствора равна: 5,5 - 2,38 = 2,15 °С.
В каком количестве воды следует растворить 20 г глюкозы, чтобы получить раствор с температурой кипения 100,2 °С?
Решение.
Температура кипения воды 100 °С. Повышение температуры кипения раст-вора Dtкип = 100,2 - 100 = 0,2 °С. Молекулярная масса глюкозы C6H12O6 - 180 г.
Из формулы (3) находим количество воды, в котором нужно растворить 20 г глюкозы, чтобы получить раствор с температурой кипения 100,2 °С:
Dtкип = E ´ (m ´ 1000 / M ´ m1) 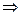 m1 = E ´ m ´ 1000 / Dtкип ´ M =
m1 = E ´ m ´ 1000 / Dtкип ´ M =
= 0,52 ´ 20 ´ 1000 / 0,2 ´ 180 = 289 г.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2858; Нарушение авторских прав?; Мы поможем в написании вашей работы!