
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы химической термодинамики. Тепловой эффект химической реакции (DН) зависит только от начального и конечного состояний системы и не зависит от промежуточных стадий процесса
|
|
|
|
Закон Гесса:
Тепловой эффект химической реакции (DН) зависит только от начального и конечного состояний системы и не зависит от промежуточных стадий процесса.
Таким образом, DН является функцией состояния.
Пример: Теплота растворения CuSO4 составляет DН1 = –66,1 кДж/моль, а теплота перевода CuSO4 в CuSO4*5H2O равна DН2 = –78,8 кДж/моль. Вычислите теплоту растворения CuSO4*5H2O (DН3).
Решение: Согласно закону Гесса DН1 = DН2 + DН3, отсюда
DН3 = DН1 – DН2 = –66,1 + 78,8 = 12,7 (кДж/моль)
 CuSO4*5H2O
CuSO4*5H2O
 |
DН2 DН3
 |
CuSO4 DН1 CuSO4*aq
Следствия из закона Гесса:
1) Стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
Пример: Вычислите DНо реакции 4СО + 2SO2 = 4CO2 + S2(г).
Решение: По справочнику находим DНо образования веществ:
DН = (4DН
= (4DН (СО2) + DН
(СО2) + DН (S2)) – (4DН
(S2)) – (4DН (СО) + 2DН
(СО) + 2DН (SО2))
(SО2))
DН = (4*(–393) + 128) – (4*(–110) + 2*(–297)) = – 410 кДж/моль
= (4*(–393) + 128) – (4*(–110) + 2*(–297)) = – 410 кДж/моль
2) Стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий сгорания исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции.
Пример: Определите DНо реакции 3С2Н2(г) = С6Н6(ж)
Решение: DН = 3DН
= 3DН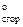 (С2Н2) – DН
(С2Н2) – DН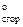 (С6Н6)
(С6Н6)
DН = 3*(–1300) – (–3268) = – 632 кДж/моль
= 3*(–1300) – (–3268) = – 632 кДж/моль
Функцией состояния является энтропия (S) – параметр, характеризующий меру упорядоченности системы: более упорядоченная система характеризуется меньшей энтропией в сравнении с менее упорядоченной. Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое, из жидкого в газообразное, при растворении кристаллических веществ, при расширении газов, при химических реакциях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состоянии. Напротив, все процессы, приводящие к возрастанию упорядоченности системы (конденсация, полимеризация, сжатие, уменьшение числа частиц), сопровождаются уменьшением энтропии.
|
|
|
Пример: Определите изменение энтропии DSo в реакциях:
а) 2SO3(г) = 2SO2(г) + О2; б) 2Н2(г) + О2(г) = 2Н2О(ж)
Решение: Не производя вычислений можно определить, что в первой реакции DSo > 0, а во второй – DSo < 0. Т.к. энтропия – функция состояния, то рассчитать изменение энтропии можно по следствию из закона Гесса:
а) DS = 2So(SO2) + So(O2) – 2S(SO3)
= 2So(SO2) + So(O2) – 2S(SO3)
DS = 2*248 + 205 – 2*257 = 187 Дж/моль*К
= 2*248 + 205 – 2*257 = 187 Дж/моль*К
б) DS = 2So(Н2Oж) – (2So(Н2) + S(O2))
= 2So(Н2Oж) – (2So(Н2) + S(O2))
DS = 2*70 – (2*131 + 205) = –327 Дж/моль*К
= 2*70 – (2*131 + 205) = –327 Дж/моль*К
Согласно II закону термодинамики в изолированных системах самопроизвольно протекают процессы, сопровождающиеся увеличением энтропии.
Функцией состояния, одновременно отражающей влияние энтальпии и энтропии на направление протекания химических процессов, служит свободная энергия Гиббса (G):
G = H – T*S
Для изобарно-изотермических процессов:
DG = DH – T*DS
Самопроизвольно будет протекать процесс, в результате которого происходит уменьшение свободной энергии системы (DG < 0). Процессы, в ходе которых энергия системы возрастает (DG > 0), не могут протекать самопроизвольно. Если DG = 0, то система находится в состоянии равновесия, ее энергия минимальна.
Величину DGо можно рассчитать по следствию из закона Гесса, используя справочные данные.
По формуле DGо = DHо – T*DSо можно рассчитать DGо при различных температурах, исходя из упрощающего предположения, что DНо и DSо не зависят от температуры. По величине DGо можно рассчитать константу равновесия (К) из соотношения:
DGо = –RTlnK; К = е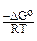
Пример: Вычислите DGо следующих реакций и определите, в каком направлении они будут протекать, если все вещества взяты при стандартных условиях. Определите константу равновесия: 4HCl + O2 Û 2Cl2 + 2H2O
|
|
|
Решение: DGо = 2DGо(Н2О) – 4DGо(HCl)
DG = 2*(–237) – 4*(–95) = –94 кДж/моль*К, DG < 0, процесс протекает самопроизвольно.
К = е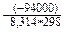 = 3*1016
= 3*1016
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1380; Нарушение авторских прав?; Мы поможем в написании вашей работы!