
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры составления условий задачи и их решение
|
|
|
|
Задача 290
Определить константу равновесия обратимой химической реакции
СН4 (г) + H2O(г) ↔ 3 Н2 (г) + СО(г)
при температуре 1000 К.
Как будет смещаться равновесие при повышении температуры и давления?
Решение:
Константа равновесия химической реакции связана со стандартной энергией Гиббса уравнением ΔGo = -RTln Kp = -2,3 RTlg Kp.
Откуда lg Kp = - ΔGo/2,3 RT.
ΔGox.p. = ΔHox.p.- TΔSox.p.
СН4 (г) + Н2O(г) ↔ 3 H2 (г) + СО(г)
| ΔНообр., кДж/моль | - 74,86 | - 241,84 | - 110,52 | |
| Sо, Дж/моль·К | 186,44 | 188,72 | 126,04 | 197,54 |
Находим ΔНох.р.
ΔНох.р. = - 110,52 – [-74,86 +(-241,84)] = 206,18 кДж/моль = 206180 Дж/моль,
Вычисляем ΔSо реакции
ΔSо = (3·126,04 + 197,54) – (186,44+188,72) = 200,5 Дж/моль·К,
Находим ΔGо реакции
ΔGо = ΔНо - ТΔSо = 206180 - 298·200,5=146431 Дж/моль,
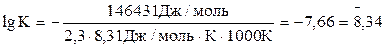 ,
,
откуда К = 2,19·10-8. Большой положительной величине ΔGо соответствует малая константа равновесия.
Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье:
1) так как реакция эндотермическая (Δ Н > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру;
2) при повышении давления равновесие будет смещаться в сторону образования меньшего числа молекул, в сторону обратной реакции (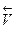 ).
).
Задача 309
В системе А(г) + 2 В(г) = С(г) равновесные концентрации равны:
[A] = 0,06 моль/л; [B] = 0,12 моль/л; [C] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение:
Константа равновесия данной реакции выражается уравнением
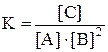 .
.
Подставляя в него данные задачи, получаем 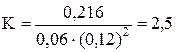 .
.
Для нахождения исходных концентраций веществ А и В учтем, что согласно уравнению реакции из 1 моля А и 2 молей В образуется I моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля вещества С, то при этом было израсходовано 0,216 моля А и 0,216×2=0,432 моля В. Таким образом, исходные концентрации равны:
[A0] = 0,06 + 0,216 = 0,276 моль/л,
[Во] = 0,12 + 0,432 = 0,552 моль/л.
Задача 315
Константа скорости некоторой реакции при 313 К равна 1,816×10-4сек-1, а при 333 К - 3,996×10-4 сек-1. Вычислить энергию активации.
Решение:
Каждая реакция характеризуется определенным энергетическим барьером; для его преодоления необходима энергия активации - некоторая избыточная энергия (по сравнению со средней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т.е. привело бы к образованию нового вещества.
Энергию активации вычисляем по уравнению Аррениуса:
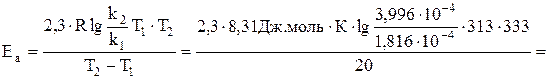

Задача 322
Температурный коэффициент скорости реакции равен 3. Во сколько раз возрастает скорость реакции при повышении температуры от 283
до 383 °С?
Решение:
Простейшая зависимость скорости реакции от температуры выражаетсяэмпирическим правилом Вант-Гоффа:
Vt+10 / Vt= kt+10 / kt= γ.
Здесь Vt и kt - скорость и константа скорости реакции при температуре t 0С;
Vt+10 и kt+10- те же величины при температуре (t+ 10 °С); γ- температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2-4. В общем случае, если температура изменилась на Dt °С, последнее уравнение преобразуется к виду
Vt+Dt / Vt= kt+Dt / kt= γDt/10.
 ;
; 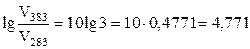 .
.
Отсюда 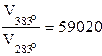 .
.
При повышении температуры на 100 0C скорость реакции увеличится в 59 020 раз.
Задача 325
Энергия активации распада метана в отсутствии катализатора равна 331,0 кДж/моль, а с катализатором – 230,0 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 1000К?
Решение:
Скорость химической реакции возрастает в присутствии катализатора. Действие катализатора объясняется тем, что при его участии возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции. При этом энергия активации реакции понижается и активными становятся некоторые молекулы, энергия которых была недостаточна для осуществления реакции в отсутствии катализатора. Обозначим энергию активации реакции без катализатора через Еа, а с катализатором - через  ; соответствующие константы скорости реакции обозначим через k и
; соответствующие константы скорости реакции обозначим через k и 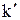 . Используя уравнение Аррениуса, находим
. Используя уравнение Аррениуса, находим
 .
.
 Получим
Получим 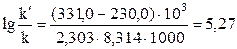 . Окончательно находим
. Окончательно находим  .
.
Таким образом, снижение энергии активации на 101 кДж привело к увеличению скорости реакции в 186 тысяч раз.
В задачах 285–300 определить константу равновесия обратимых химических реакций при заданной температуре и указать, как будет смещаться равновесие при повышении температуры или давления
| № задачи | Уравнение реакции | Т, К |
| 285. | V2O5(к)+5Fe(к) «2V(к) + 5 FeO(к) | |
| 286. | CO2(г) + H2(г) «CO(г) + H2O(г) | |
| 287. | CO2(г) + H2(г) «CO(г) + H2O(г) | |
| 288. | 2Cu2O(к) + Cu2S(к)«6 Cu(к) + SO2(г) | |
| 289. | TiI4(к) «Ti(к) + 2I2 (г) | |
| 290. | CH4(г) + H2O(г) «3 H2(г) + CO(г) | |
| 291. | Fe2O3(к) + CO(г)«2 FeO(к) + 2CO2(г) | |
| 292. | 3Fe(к) + C(гр) «Fe3C(к) | |
| 293. | SiCl4(г) + 2H2(г) «Si(к) + 4HCl(г) | |
| 294. | GeO2(к) + 4HCl(г) «GeCl4(к) + 2 H2O(г) | |
| 295. | Li2O(к) + 3C(гр.)«Li2C2(к) +CO(г) | |
| 296. | Li3N(к) + 3H2(г) «3 LiH(к) + NH3(г) | |
| 297. | CaCO3 (к)+ 4 C(гр.)«CaC2(к) + 3CO(г) | |
| 298. | WO3(к) + 3H2 (г)«W(к) + 3H2O(г) | |
| 299. | 2 СО + О2 ↔ 2 СО2 | |
| 300. | СОСl2 ↔ CO + Cl2 |
В задачах 301–314 вычислить константу равновесия химической реакции и определить начальные концентрации вступивших в реакцию веществ
| № задачи | Уравнение реакции | Равновесные концентрации См, моль/л |
| Cl2 + CO «COCl2 | См: Cl2=2.5; CO=1.8; COCl2=3.2 | |
| 2NO2«2NO + O2 | См: NO2=0.02; NO=0.08; O2=0.16 | |
| 2SO2 + O2 «2SO3 | См: SO2=0.02; O2=0.4; SO3=0.3 | |
| N2 + 3H2 «2NH3 | См: N2=2.5; H2=1.8; NH3=3.6 | |
| 2NO + O2 «2NO2 | См: NO=0.056; O2=0.028; NO2=0.044 | |
| 2N2 + O2 «2N2O | См: N2=0.072; O2=1.12; N2O=0.84 | |
| H2 + I2 «2HI | См: H2=0.025; I2=0.005; HI=0.009 | |
| N2 + 3H2 «2NH3 | См: N2=3; H2=9; NH3=4 | |
| A + 2B «C | См: A=0.06; B=0.12; C=0.216 | |
| 3 A + B ↔ 2 C | См: A=0.03; B=0.01; C=0.08 | |
| 2 NO2 ↔ 2 NO + O2 | См: NO2 =0,006; NO =0,024; O2=0,012 | |
| CO + Cl2 ↔ COCl2 | См: Cl2 =0,3; CO = 0,2; COCl2=1,2 | |
| 2 SO2 + O2↔ 2SO3 | См: SO2 =0,04; O2=0,06; 2SO3=0,02 | |
| N2 + 3H2 ↔ 2NH3 | См: NH3 = 0,4; N2 = 0,03; H2 = 0,1 |
В задачах 315–319 определить, энергию активации химической реакции по следующим данным:
| № задачи | Температура Т1, К | Константа скорости k1, 1/с | Температура Т2, К | Константа скорости k2, 1/с |
| 1,816×10-4 | 3,996×10-4 | |||
| 3,0×10-2 | 4,0×10-1 | |||
| 7,5 | 4,5×102 | |||
| 4,04×10-5 | 7,72×10-5 | |||
| 2,0×10-2 | 0,38 |
В задачах 320–324 определить, во сколько раз возрастет скорость химической реакции, если температура повысилась на 100 oС
| № задачи | Начальная температура, 0С | Температурный коэффициент, γ |
| 2,50 | ||
| 1,87 | ||
| 3,00 | ||
| 2,00 | ||
| 2,70 |
В задачах 325–329 определить, во сколько раз возрастает скорость химической реакции при применении катализатора по сравнению со скоростью реакции, идущей без катализатора. Реакция идет при температуре 1000 К
| № задачи | Реакция распада | С катализатором | Без катализатора Еа, кДж/моль | |
| катализатор |  , кДж/моль , кДж/моль
| |||
| CH4 | Pt | 230,0 | 331,0 | |
| N2O | Pt | 136,0 | 244,0 | |
| N2O | Au | 121,0 | 244,0 | |
| HI | Pt | 58,6 | 184,0 | |
| HI | Au | 108,0 | 184,0 |
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2953; Нарушение авторских прав?; Мы поможем в написании вашей работы!