
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тесты. Химическая кинетика и равновесие
|
|
|
|
Вариант 1
1. Укажите математическое выражение закона действия масс для реакции 4NH3(г)+3О2(г)=2N2(г)+6Н2О(ж)
1) V= к C4NH3*C3O2; 2) V= к CNH3* CO2; 3) V= к CNH3* CO2*CN2*CH2O;
4) нет ответа; 5) V= к C4NH3* C3O2*C2N2*C6H2O?
2. 
 Укажите математическое выражение скорости прямой реакции 3Fe(к)+4H2O(г) Fe3O4(к)+4Н2(г)
Укажите математическое выражение скорости прямой реакции 3Fe(к)+4H2O(г) Fe3O4(к)+4Н2(г)
1) V= к С3Fe; 2) V= к СН2О; 3) V= к С4Н2О;
4) V= к С3Fe* С4Н2О; 5)V= к СFe* СН2О?
3. Укажите математическое выражение закона действия масс для реакции Ва(к)+2HCl(р) = BaCl2(р)+H2(г)
1) V= к CBa*C2HCl; 2) V= к CBa*CHCl; 3) V= к CBa*C2HCl*CBaCl2*CH2;
4) нет ответа; 5) V= к C2HCl?
4. Укажите математическое выражение скорости прямой реакции
 MgCO3(к) MgO(к)+CO2(г)
MgCO3(к) MgO(к)+CO2(г)
1) V= к CMgCO3; 2) нет ответа; 3) V=к; 4) V=к CMgO*CCO2; 5) V=к CCO2?
5. В растворе проходит реакция по уравнению KCl(р)+HClO(р)=Cl2(г)+KOH(р)
Во сколько раз изменится скорость реакции при разбавлении реагирующей смеси в 6 раз
1) Уменьшится в 6 раз; 2) уменьшится в 12 раз; 3)увеличится в 12 раз;
4) уменьшится в 36 раз; 5) не изменится?
Вариант 2
1. Во сколько раз возрастет скорость реакции 2NO(г)+Cl2(г)=2NOCl(г) при увеличении давления в системе в 3 раза
1) В 27 раз; 2) в 9 раз; 3) в 6 раз; 4) в 2 раза; 5) в 18 раз?
2. Во сколько раз следует изменить (увеличить или уменьшить) давление, чтобы скорость образования NO2 по реакции 2NO(г)+O2(г)=2NO2(г) возросла в 1000 раз
1) Уменьшить в 100 раз; 2) увеличить в 1000 раз; 3) увеличить в 10 раз;
4) увеличить в 100 раз; 5) уменьшить в 10 раз?
3. 
 Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в системе 2NO(г)+О2(г) 2NO2(г) при увеличении давления в 2 раза
Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в системе 2NO(г)+О2(г) 2NO2(г) при увеличении давления в 2 раза
1) в 2 раза; 2) в 4 раза; 3) в 3/2 раза; 4) в 0,5 раза; 5) в 2/3 раза?
4. Во сколько раз увеличится скорость реакции при повышении температуры от 400 до 700 С Температурный коэффициент равен 3
1) В 9 раз; 2) в 3 раза; 3) в 27 раз; 4) в 90 раз; 5) в 30 раз?
5. На сколько градусов необходимо понизить температуру, чтобы скорость реакции уменьшилась в 27 раз, если температурный коэффициент равен 3
1) на 90С; 2) на 300С; 3) на 810С; 4) на 30С; 5) на 270С?
Вариант 3
1. При повышении температуры на каждые 100С скорость некоторой химической реакции увеличивается в 4 раза. При какой температуре следует проводить реакцию, чтобы скорость реакции, идущей при 1000С, уменьшилась в 16 раз
1) при 200С; 2) при 400С; 3) при 800С; 4) при 1160С; 5) при 640С?
2. Кинетическое уравнение реакции CaO(к)+CO2(г)=CaCO3(к) имеет вид V=кССО2. Определите общий порядок реакции
1) первый; 2) второй; 3) третий; 4) нулевой; 5) дробный?
3. Определите порядок реакции С6Н6(г)+Br2(ж)=C6H5Br(ж)+HBr(г)
1) дробный; 2) нулевой; 3) третий; 4) второй; 5) первый?
4. При какой концентрации воды гидролитическое разложение сахара с образованием глюкозы и фруктозы С12Н22О11(р)+Н2О(р)=С6Н12О6(р)+С6Н12О6(р) является реакцией второго порядка
1) высокой; 2) средней; 3) низкой; 4) любой; 5) нет ответа?
5. Общий порядок реакции Н2(г)+I2(г)=2HI(г) равен 2. Чему равны частные порядки реакции по водороду и иоду
1) Нулевой порядок по водороду и первый по иоду;
2) Первый порядок по водороду и второй по иоду;
3) Нулевой порядок по водороду и иоду;
4) Второй порядок по водороду и иоду;
5) Первый порядок по водороду и иоду?
Вариант 4
1. Укажите выражение константы равновесия реакции

 Fe2O3(к)+3СО(г) 2Fe(к)+3СО2(г)
Fe2O3(к)+3СО(г) 2Fe(к)+3СО2(г)
1) Кс= ; 2) Кс=
; 2) Кс=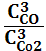 ; 3) Кс=
; 3) Кс=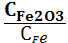 ;
;
4) Кс= 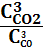 ; 5) Кс=
; 5) Кс= 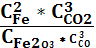 ?
?
2. Укажите выражение константы равновесия реакции

 4HCl(г)+O2(г) 2Cl2(г)+2Н2О(г)
4HCl(г)+O2(г) 2Cl2(г)+2Н2О(г)
1) Кр=; 2) Кр= 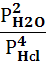 ; 3) нет ответа; 4) Кр=; 5) Кр=
; 3) нет ответа; 4) Кр=; 5) Кр=  ?
?
3. Укажите выражение константы равновесия реакции
 Cl2(г)+Н2О(р) HCl(р)+HClO(р)
Cl2(г)+Н2О(р) HCl(р)+HClO(р)
1) Кс= СCl2; 2) Кс= 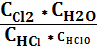 ; 3) Кс=
; 3) Кс= 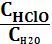 ;
;
4) Кс=  ; 5) Кс=
; 5) Кс= 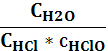 ?
?
4. 
 Вычислите константу равновесия реакции СО2(г)+2Н2(г) СН3ОН(г), если равновесные концентрации ССО2=0,3 моль/л, СН2=1,1 моль/л, ССН3ОН=2,1 моль/л
Вычислите константу равновесия реакции СО2(г)+2Н2(г) СН3ОН(г), если равновесные концентрации ССО2=0,3 моль/л, СН2=1,1 моль/л, ССН3ОН=2,1 моль/л
1) 0,17; 2) 5,79; 3) 6,36; 4) 0,16; 5) 5,4?
5. 
 В реакции Н2(г)+I2(г) 2HI(г) исходные концентрации Н2 и I2 равны каждая 1 моль/л. Вычислите равновесные концентрации веществ, если константа равновесия равна 50
В реакции Н2(г)+I2(г) 2HI(г) исходные концентрации Н2 и I2 равны каждая 1 моль/л. Вычислите равновесные концентрации веществ, если константа равновесия равна 50
1) нет ответа; 2) СН2=CI2=0.61, CHI=0,78; 3) CH2=CI2=0.22, CHI=1.56;
4) СH2=CI2=0.00, CHI=2.0; 5) CH2=CI2=0.5, CHI=1,0?
Вариант 5
1. Исходные концентрации оксида углерода и паров соответственно равны 0,08 моль/л. Вычислите равновесные концентрации СО, Н2О, Н2 в системе СО+Н2О СО2+Н2, если равновесная концентрация СО2 оказалась равной 0,05 моль/л. Рассчитайте константу равновесия реакции.
1) 
 ССО=СН2О=0,03, СН2=0,05, Кс=2,78; 2) ССО=СН2О=0,03, СН2=0,05, Кс=0,36;
ССО=СН2О=0,03, СН2=0,05, Кс=2,78; 2) ССО=СН2О=0,03, СН2=0,05, Кс=0,36;
3) ССО=СН2О=0,13, СН2=0,05, Кс=1,47; 4) Нет ответа;
5) ССО=СН2О=0,13, СН2=0,05, Кс=6,76?
2. 
 Действием каких факторов можно сместить вправо равновесие реакции СО2(г)+2Н2(г) СН3ОН(г); DН0=193,3 кДж
Действием каких факторов можно сместить вправо равновесие реакции СО2(г)+2Н2(г) СН3ОН(г); DН0=193,3 кДж
1) Введением катализатора; 2) понижением температуры 3) понижением давления; 4) увеличением концентрации СО2 или Н2; 5) увеличением объема реакционного сосуда?
3. Каким путем можно повысит выход СО2 в следующей реакции:
 СаСО3(к) СаО(к)+СО2(г); DН0=179 кДж
СаСО3(к) СаО(к)+СО2(г); DН0=179 кДж
1) Повысить давление; 2) понизить давление; 3) увеличить концентрацию CaO; 4) уменьшить концентрацию СаСО3; 5) нет ответа?
4. В каких из нижеприведенных обратимых реакций изменение давления не вызовет нарушения равновесия
1) 
 Нет ответа; 2) СО(г)+Н2О(г) СО2+Н2(г);
Нет ответа; 2) СО(г)+Н2О(г) СО2+Н2(г);


 3)СОСl2(г) СО(г)+Cl2(г); 4) MgCO3(к) MgO(к)+СО2(г);
3)СОСl2(г) СО(г)+Cl2(г); 4) MgCO3(к) MgO(к)+СО2(г);
 5) 2NO(г)+O2(г) 2NO2(г)?
5) 2NO(г)+O2(г) 2NO2(г)?
5. 
 Как следует одновременно изменить температуру и давление в системе CO2(г)+С(графит) 2СО(г); DН<0, что бы повысить выход оксида углерода
Как следует одновременно изменить температуру и давление в системе CO2(г)+С(графит) 2СО(г); DН<0, что бы повысить выход оксида углерода
1) увеличить температуру и давление;
2) уменьшить температуру и давление;
3) уменьшить температуру, увеличить давление;
4) увеличить температуру, уменьшить давление;
5) температуру не изменять, давление увеличить.
4. ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1795; Нарушение авторских прав?; Мы поможем в написании вашей работы!