
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз. Электролиз представляет собой процесс, в котором окислительно-восстановительные реакции происходят под действием постоянного электрического тока
|
|
|
|
Электролиз представляет собой процесс, в котором окислительно-восстановительные реакции происходят под действием постоянного электрического тока. Химические реакции при электролизе обратны реакциям в гальванических элементах.
При электролизе растворов солей необходимо помнить правила:
1. Катионы металлов, имеющих малую величину стандартного электродного потенциала (от Li+ до AI3+ включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды:
2H2O +2e ® H2 + 2OH–.
2. Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от AI до H2) при электролизе восстанавливаются одновременно с молекулами воды. Причиной этого явления служит более высокая концентрация катионов металла в растворах по сравнению с ионами водорода (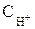 = 10–7моль/л), а также явление перенапряжения.
= 10–7моль/л), а также явление перенапряжения.
3. Катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода (от Sb3+ + до Аu+), при электролизе практически полностью восстанавливаются на катоде.
4. На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом анионы бескислородных кислот (S2-, I-,Вг-, С1-) при их достаточной концентрации легко окисляются. Если же раствор содержит анионы кислородных кислот (например, SO42–, NO3–, СО3 2–, PO43–), то на аноде окисляются не эти ионы, а молекулы воды:
2H2O + 4e ® O2 + 4H+.
5. Растворимый анод сам подвергается окислению (растворению), т.е. поcылает электроны во внешнюю цепь. При отдаче электронов смещается равновесие между электродом и раствором:
Me ↔ Men+ + ne.
металл уходят уходят во
анода в раствор внешнюю цепь
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 917; Нарушение авторских прав?; Мы поможем в написании вашей работы!