
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз водного раствора КВr
|
|
|
|
Решение:
Ионы калия обладают меньшей окислительной способностью, чем вода. Поэтому на катоде происходит восстановление воды, а на аноде – окисление брома, которые обладают большей восстановительной способностью, чем вода.
катод K+, HOH; 2H2O + 2e → H2 + 2OH– в-е, о-ль PH > 7
анод Br–, HOH; 2Br– – 2e = Br2 о-е, в-ль
 |
катионы активного металла калия, которые не восстанавливаются на катоде, накапливаются в прикатодном пространстве.
В целом процесс выражается уравнением
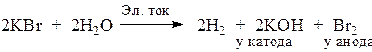
4. Электролиз водного раствора СuCl2.
Решение:
В растворе хлорид меди (II) диссоциирует на ионы: CuCl2 «Cu2+ + 2Cl–
Значение стандартного электродного потенциала меди (0,34В) положительно, следовательно, ионы меди(II) будут легко восстанавливаться в водных растворах: катод (-) Сu2+ + 2e ® Сu.
Хлорид -анионы, как и многие анионы бескислородных кислот, окисляются в водных растворах: анод (+) 2 СI– -2e® С12
Суммарное уравнение процесса:
 1 2 Cl– – 2e ® Cl2 o-e, в-ль;
1 2 Cl– – 2e ® Cl2 o-e, в-ль; 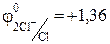 В
В
1 Cu2+ + 2е ® Cu в-е, о-ль; 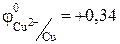 В
В
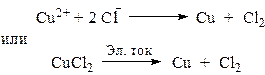
Задача 503
Вычислить массу серебра, выделившуюся на катоде при пропускании тока силой 6А через раствор нитрата серебра в течение 30 мин.
Решение:
Соотношения между количеством прошедшего электричества и количеством вещества, выделившегося при электролизе, были открыты английским физиком М. Фарадеем в 30-х годах XIX века.
Первый закон. Количества веществ, превращенных при электролизе, пропорциональны количеству электричества, прошедшего через электролит.
Второй закон. При прохождении одного и того же количества электричества через различные электролиты количества различных веществ, испытывающие превращение у электродов, пропорциональны химическим эквивалентам этих веществ.
Для выделения или превращения с помощью тока 1г-экв любого вещества необходимо всегда одно и то же количество электричества, называемое числом Фарадея.
Выразим законы Фарадея общим уравнением: 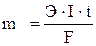 ,
,
где m – масса продукта электролиза, г; I – сила тока, А; t – время, с; F – число Фарадея – 96500 к/г-экв; Э – химический эквивалент, г/г-экв.
Вычисляем массу, выделившуюся на катоде, серебра:
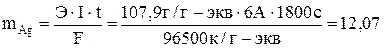 г.
г.
Задача 509
Найти объем кислорода (условия нормальные), который выделится при пропускании тока силой 6А в течение 30 мин через водный раствор KOH.
Решение:
При вычислении объемов выделившихся газов представим уравнение Фарадея в следующей форме: 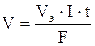 ,
,
где V – объем выделившегося газа, л; Vэ – его эквивалентный объем, л/моль.
Поскольку при нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, а кислорода - 5,6 л/моль, то получим
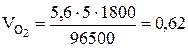 л.
л.
Задача 515
При электролизе водного раствора АgNO3 с нерастворимым анодом в течение 50 мин при силе тока в 3,0 А на катоде выделилось 9,6 г серебра. Вычислить выход по току.
Решение:
При практическом проведении электролиза действительный расход тока, вследствие протекания тех или иных побочных процессов, обычно превышает количество его, рассчитанное согласно закону Фарадея. Поэтому на практике часто приходится иметь дело с коэффициентом использования тока, или с так называемым выходом по току (η – эта).
Выходом по току называется отношение количества практически выделенного при электролизе вещества к тому количеству его, которое должно было бы выделиться согласно закону Фарадея.
Выход по току находим как 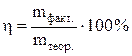 ,
, 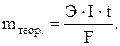
Отсюда 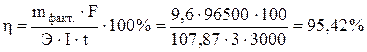 .
.
Задача 532
Сколько времени нужно пропускать ток силой 2,0 А через раствор сульфата никеля, чтобы покрыть металлическую пластинку 200 см2 слоем никеля, толщиной 0,01 мм, если плотность никеля 8,9 г/см3. Выход по току составляет 90 %.
Решение:
Объем покрытия V=S×h = 200× 0,001= 0.2 см3
Масса будет равна mфакт = V × r = 0,2 × 8,9 = 1,78 г.
Эквивалентная масса никеля Э = 29,345 г/моль.
Решая уравнение
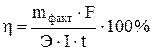 относительно t и подставляя в него числовые значения, находим
относительно t и подставляя в него числовые значения, находим 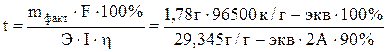 = 3251 с = 54,19 мин.
= 3251 с = 54,19 мин.
Итак, при практическом осуществлении электролиза часто наблюдаются кажущиеся отклонения от закона Фарадея. Чаще всего они проявляются при катодном восстановлении электроотрицательных металлов, когда часть электрического тока расходуется на разряд ионов водорода.
Законы электролиза относятся к электролизу растворов, расплавов и твердых электролитов с чисто ионной проводимостью.
Задача 533
Определить толщину слоя металла – Pt (в миллиметрах), нанесенного на другой металл гальваническим методом. Исходный электролит H2[PtCl6]. Площадь поверхности металлической пластинки 250 см2, плотность пластины 21,47 г/см2. Время электролиза 45 мин, ток силой 0,2 А, выход по току составляет 90%.
Решение:
Зная выход по току, определяем количество выделенного при электролизе вещества:
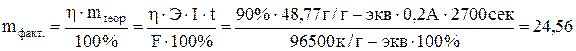 г.
г.
Тогда объем покрытия: 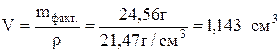 и толщина слоя:
и толщина слоя: 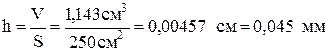 .
.
При выполнении задания рекомендуется использовать методические указания [1].
В задачах (472–502) разобрать процессы, протекающие у электродов при электролизе водных растворов веществ, для каждого из них составить общее уравнение реакции
| № задачи | Вещества |
| Na2SO4, Cd(NO3)2, KBr, CuCl2 | |
| ZnSO4, NaCl, SnCl2, KNO3 | |
| BaCl2, FeSO4, K3PO4, ZnJ2 | |
| Sr(NO3)2, Cr2(SO4)3, AuCl3, RbCl | |
| Ca(NO3)2, PdCl2, CoSO4, LiCl | |
| FeCl3, MgSO4, Cd(NO3)2, CaJ2 | |
| Na2CrO4, SnSO4, HgCl2, BaBr2 | |
| K2SO3, NiSO4, CuJ2, MgCl2 | |
| Pb(NO3)2, H2SO4, HgCI2, KBr | |
| KOH, CuSO4, МgJ2, SnCl4 | |
| Ba(OH)2, SrCI2, SnBr2, Zn(NO3)2 | |
| HNO3, РЬ(СН3СOO)2, RbCI, ZnBr2 | |
| Sr(ОH)2, BaCl2, СuJ2, Fe2(SO4)3 | |
| H3PO4, TlNO3, CaJ2, ZnBr2 | |
| NaOH, Ni(NO3)2, KCl, PtCl2 | |
| Co(NO3)2, RbOH, MgCl2, AuCl3 | |
| LiCl, H2SO4, ZnBr2, Ag3PO4 | |
| NiSO3, FeS, RbOH, CdCrO4 | |
| Cu(OH)2, H4PtO4, KJ, CaSO4 | |
| LiF, KNO3, TlCl, BaSO4 | |
| PbSO4, CuS, Hg2(NO3)2, AgJ | |
| Zn(OH)2, CuF2,, KClO4, H2CrO4 | |
| CsOH, HMnO4, AICI3, Pd(NO3)2 | |
| NiCI2, К2SO4, Ве(OН)2, CH3COOH | |
| MgCl2, RbClO4, NaNO3, HgS | |
| BiCl3, HBr, Mg(OH)2, BaCO3 | |
| ZnS, MgCO3, Sn(NO3)2, TiCl4 | |
| CaSO4, H2CO3, Sr(OH)2, СоBr2 | |
| KMnО4, Bi(NO3)3, PbS, FeSO3 | |
| Cr(ClО4)3, Na2S, НСl, KVO3 | |
| Ag3PO4, NaNO3, CaCl2, PbJ2 |
В задачах 503–508 вычислить массу вещества, выделившуюся при пропускании тока через раствор в течение времени:
| № задачи | Процесс | Ток, А | Время, мин |
| Осаждение серебра из раствора AgNO3 Осаждение меди из раствора СuSО4 Осаждение золота из раствора АuС13 Осаждение олова из раствора SnSO4 Осаждение меди из раствора CuCI2 Осаждение меди из раствора Сu(NО3)2 | 6,0 1,5 1,5 |
В задачах 509–514 найти объем газа (условия нормальные), который выделится при пропускании тока в течение определенного времени через водный раствор соли
| № задачи | Процесс | Ток, А | Время, мин |
| Выделение кислорода из водного раствора КОН Выделение водорода из водного раствора КОН Выделение водорода из H2SO4 Выделение кислорода из раствора NаОН Выделение водорода из раствора HNO3 Выделение хлора из раствора NaCI | 1,5 |
В задачах 515–524 вычислить выход по току при электролизе по следующим данным:
| № задачи | Процесс | Ток, А | Время, мин | Изменение массы электрода, г |
| Осаждение серебра из раствора AgNO3 | 3,0 | +9,6 | ||
| Осаждение меди из раствора CuSO4 | 2,5 | +0,72 | ||
| Осаждение никеля из раствора NiSO4 | 10,0 | +53,21 | ||
| Осаждение цинка из раствора ZnSO4 | 3,0 | +0,46 | ||
| Осаждение меди из раствора Na[Cu(CN)2] | 10,0 | +58,2 | ||
| Растворение меди на аноде | 2,0 | -16,0 | ||
| Растворение серебра на аноде | 3,0 | -8,3 | ||
| Растворение никеля на аноде | 5,0 | -0,90 | ||
| Выделение хлора на аноде | 1,05 | 1,25 | ||
| Осаждение магния из расплава MgCl2 | 0,034 | 0,1869 |
В задачах 525–532 определить время, необходимое для нанесения слоя одного металла на другой гальваническим способом
| № задачи | Осажденный металл | Плотность метала, г/см3 | Толщина слоя, мм | Площадь поверхности, см2 | Ток, А | Выход по току, % | Электролит |
| Ni | 8.90 | 0.01 | 2.0 | NiSO4 | |||
| Cu | 8.93 | 0.05 | 5.0 | CuSO4 | |||
| Zn | 7.14 | 0.25 | ZnSO4 | ||||
| Ag | 10.49 | 0.02 | 0.5 | Na[Ag(CN)2] | |||
| Au | 19.32 | 0.001 | 0.25 | K[Au(CN)2] | |||
| Cd | 8.64 | 0.05 | CdSO4 | ||||
| Pt | 21.47 | 0.001 | 0.2 | H2[PtCl6] | |||
| Pb | 11.30 | 0.01 | 2.0 | Pb[BF4]2 |
В задачах 533–540 определить толщину слоя металла (в миллиметрах), нанесенного на другой металл гальваническим методом
| № задачи | Металлопокрытие | Ток, А | Время электролиза, мин | Выход по току, % | Электролит | ||
| Металл | плотность, г/см3 | площадь поверхн., см2 | |||||
| Pt | 21,47 | 0,2 | H2[PtCl6] | ||||
| Ag | 10,49 | 0,5 | Na[Ag(CN)2] | ||||
| Au | 19,32 | 0,3 | K[Au(CN)2] | ||||
| Cd | 8,64 | 5,0 | CdSO4 | ||||
| Zn | 7,14 | 7,5 | ZnSO4 | ||||
| Cu | 8,93 | 2,7 | CuSO4 | ||||
| Ni | 8,90 | 2,0 | NiSO4 | ||||
| Pb | 11,30 | 1,0 | Pb[BF4]2 |
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 11134; Нарушение авторских прав?; Мы поможем в написании вашей работы!