
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Произведение растворимости. В насыщенном растворе малорастворимого электролита устанавливается равновесие между осадком электролита и ионами электролита в растворе
|
|
|
|
В насыщенном растворе малорастворимого электролита устанавливается равновесие между осадком электролита и ионами электролита в растворе.
Например: BaSO4 ↔ Ва2+ + SO42–.
в осадке в растворе
В растворах электролитов состояние ионов определяется их активностями, поэтому константа равновесия процесса выразится следующим уравнением: К= α (Ва2+) · α (SO42-) / α (ВаSO4).
Активность твердого сульфата бария есть величина постоянная, отсюда следует, что произведение активностей ионов Ва2+ и SO42– есть постоянная величина, называемая произведением растворимости, и обозначается
α Ва2+ · α SO42- = ПР ВаSO4.
Если электролит очень мало растворим, то произведение активностей ионов можно заменить произведением их концентраций
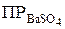 = [Bа2+ ] · [SO42– ].
= [Bа2+ ] · [SO42– ].
Если молекула электролита при диссоциации образует два и несколько одинаковых ионов, то концентрации этих ионов должны быть возведены в соответствующие степени, например: 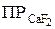 = [Cа2+ ] · [F– ]2.
= [Cа2+ ] · [F– ]2.
Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. Растворение же осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения произведения растворимости.
Исходя из значений ПР, можно вычислять растворимость малорастворимых электролитов в воде и растворах, содержащих другие электролиты.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 996; Нарушение авторских прав?; Мы поможем в написании вашей работы!