
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розвиток аналітичної хімії та методів дослідженняу ХХ столітті
|
|
|
|
Дактилоскопія
Однією з особливостей розслідування злочину є не тільки вміння виявляти і використовувати сліди події, а й вміння їх закріпити. В уяві більшості пересічних громадян криміналістичні дослідження, в першу чергу, пов’язані з пошуком та збереженням відбитків пальців. Цим аспектом криміналістичної діяльності займається наука про відбитки пальців – дактилоскопія. Варто зазначити, що дослідження пальцевих слідів у криміналістиці також не обходиться без хімічних методів виявлення.
Оскільки зміст матеріалу з історії дактилоскопії досить об’ємний, його розгляд вважаємо за доцільне перенести на початок вивчення теми 2: „Пошук і збереження відбитків пальців. Дактилоскопія”.
Активного розвитку наукові дослідження засобів боротьби зі злочинністю дістали у другій половині XIX ст. Цьому сприяли досягнення наук, передусім у хімії і судовій медицині, та судова реформа 1864 р., яка дозволяла їх використовувати.  Відомо, що саме наприкінці XIX ст. криміналістика виникає як самостійна наука. Засновниками її вважають австрійського професора Ганса Гросса (1847‑1915 рр.) і французького криміналіста Альфонса Бертильона (1853‑1914 рр.). У 1893 році в місті Граці, на території Австро‑Угорської імперії, було опубліковано книгу „Керівництво для судових слідчих, членів загальної та жандармської поліції”. Ця праця російською мовою вийшла трьома випусками у Смоленську (1895‑1897 рр.). Її автор – Ганс Гросс – узагальнив досвід, зібраний ним за 20 років роботи на посаді судового слідчого. Дослідник пропонував застосовувати у слідчій практиці такі тактичні й технічні прийоми, в яких використовуються дані різних (переважно природничих) наук, спеціально пристосованих для розслідування злочинів. Нову галузь знання Г.Гросс визначив як науку „про реальності кримінального права”, що базується на змішаному правовому та природничо‑історичному методі. Цю науку Г.Гросс назвав криміналістикою. Згідно з таким розумінням криміналістики Г.Гросс вважав її предметом учення про виявлення й використання речових доказів, зокрема правила роботи зі слідами, підробними документами тощо; вивчення окремих видів злочинів.
Відомо, що саме наприкінці XIX ст. криміналістика виникає як самостійна наука. Засновниками її вважають австрійського професора Ганса Гросса (1847‑1915 рр.) і французького криміналіста Альфонса Бертильона (1853‑1914 рр.). У 1893 році в місті Граці, на території Австро‑Угорської імперії, було опубліковано книгу „Керівництво для судових слідчих, членів загальної та жандармської поліції”. Ця праця російською мовою вийшла трьома випусками у Смоленську (1895‑1897 рр.). Її автор – Ганс Гросс – узагальнив досвід, зібраний ним за 20 років роботи на посаді судового слідчого. Дослідник пропонував застосовувати у слідчій практиці такі тактичні й технічні прийоми, в яких використовуються дані різних (переважно природничих) наук, спеціально пристосованих для розслідування злочинів. Нову галузь знання Г.Гросс визначив як науку „про реальності кримінального права”, що базується на змішаному правовому та природничо‑історичному методі. Цю науку Г.Гросс назвав криміналістикою. Згідно з таким розумінням криміналістики Г.Гросс вважав її предметом учення про виявлення й використання речових доказів, зокрема правила роботи зі слідами, підробними документами тощо; вивчення окремих видів злочинів.
Гросс став активним прибічником використання у криміналістиці нових технічних засобів, зокрема, оптичного мікроскопа, і вперше дійшов висновку про те, що пил, з яким ми постійно стикаємось, утворюється в результаті руйнування навколишніх матеріальних предметів. На його думку, вивчення частинок пилу під мікроскопом могло б допомогти у відновленні обстановки на місці події і відіграти важливу роль у розкритті злочину. Гросс стверджував, що будь-яка матеріальна взаємодія залишає речові докази. Таким чином, вивчення слідів дає можливість встановити і відновити структуру об’єктів, які ці сліди утворили.
Наприкінці ХІХ століття розробку класичних методів аналізу було завершено. Вчені вже володіли надійними методиками якісного та кількісного аналізу практично для будь-якої неорганічної речовини. Але використання цих методів у криміналістичній практиці гальмувалось тим, що для аналізу необхідно було брати порівняно велику кількість речовини дослідного зразка (0,01 г – 1 г). Важливість ідей Гросса було гідно оцінено лише через сорок років, коли у 30‑х роках XX століття у хімічних лабораторіях почали з’являтися фізичні прилади. Вони дозволили досліджувати зразки речовини, розмір яких є недоступним для безпосереднього людського сприйняття. Крім того, завдяки новим інструментам хіміки вперше змогли відслідковувати за дуже слабкими змінами концентрацій речовин, які знаходяться за межами чутливості класичних методів.
Іншою проблемою проведення криміналістичних досліджень була можливість здійснення аналізу речовин лише у розчинах. Постала необхідність в аналізі предметів, взятих у якості речових доказів, не піддаючи їх руйнуванню. Серед таких фізичних методів дослідження складу речовин, які почали активно використовуватись у хімічному аналізі, найважливіше місце посідає спектральний аналіз, відкритий німецькими вченими Г.Кірхгофом і Р.Бунзеном у 1859 році.
Стрімкий розвиток аналітичної хімії в ХХ ст. зобов’язаний саме удосконаленню старих і появі великої кількості нових методів аналізу: хімічних, фізико-хімічних та суто фізичних. Так, 40‑50‑і роки ХХ ст. відзначені інтенсивним пошуком і впровадженням нових фізичних методів дослідження. В ці роки набули застосування спектрофотометрія, молекулярна, ультрафіолетова та інфрачервона спектроскопія, мас‑спектрометрія. Набула подальшого розвитку хроматографія, з’явились нові її види: тонкошарова, газова, газорідинна та інші. Починаючи з 60‑х років у повсякденну практику передових хімічних лабораторій впроваджується використання ЕОМ, які все більшою мірою здійснюють контроль за процесами вимірювання, плануванням експеримента, а також за надійністю експериментальних результатів. З того часу зазначені фізичні методи широко застосовуються в криміналістиці.
Cпектральний аналіз (спектрографічний аналіз) – фізичний метод якісного і кількісного визначення хімічного складу речовини на основі вивчення спектрів. Якісний аналіз встановлює наявність або відсутність в спектрі ліній, характерних для певних хімічних елементів. Кількісне визначення вмісту елемента грунтується на емпіричній залежності інтенсивності спектральних ліній від концентрації елемента у пробі: чим помітніша лінія певного елемента у спектрі випромінювання або поглинання, тим більше таких атомів (молекул). Оптичний спектральний аналіз характеризується відносною простотою виконання, відсутністю складної підготовки проб до аналізу, незначною кількістю досліджуваної речовини (10‑30 мг). Чутливість методу спектрального аналізу досягає 10‑11 г. Атомні спектри (поглинання або випромінювання) одержують переведенням речовини в пароподібний стан шляхом нагрівання проби до 1‑10 тис.°C або за допомогою електричного розряду всіх видів (дуга, іскра та ін.). В першому випадку причиною збудження атомів є зіткнення їх з іншими атомами, в другому – з електронами.
Спектральний аналіз грунтується на явищі дисперсії світла (різного його заломлення залежно від частоти). Спектр – це розміщення електромагнітного випромінювання, впорядковане за довжиною хвилі або за частотою. Спектр видимого світла є послідовністю кольорів (червоного, оранжевого, жовтого, зеленого, блакитного, синього та фіолетового). Кожний колір відповідає певній довжині хвилі.

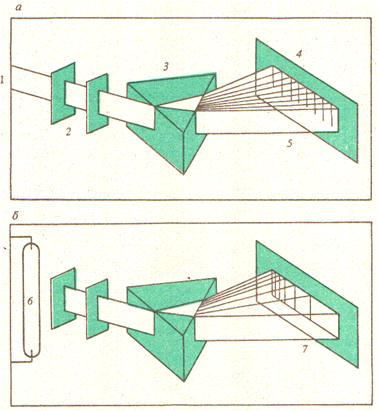 Суцільний, або неперервний спектр, в якому присутні всі довжини хвиль, виникає при проходженні видимого світла крізь дифракційну гратку. Якщо пропустити сонячне світло або світло від електричної лампи крізь щілину і утворений промінь направити на призму, а потім на екран, то з’явиться райдужна смуга, яка складається з окремих чистих кольорів. Такий спектр дають, наприклад, непрозорі розжарені тіла (вугілля, нитка електролампи).
Суцільний, або неперервний спектр, в якому присутні всі довжини хвиль, виникає при проходженні видимого світла крізь дифракційну гратку. Якщо пропустити сонячне світло або світло від електричної лампи крізь щілину і утворений промінь направити на призму, а потім на екран, то з’явиться райдужна смуга, яка складається з окремих чистих кольорів. Такий спектр дають, наприклад, непрозорі розжарені тіла (вугілля, нитка електролампи).
Лінійчасті спектри випромінювання (емісії) складаються з яскравих ліній або смуг на темному фоні. Вони утворюються, коли речовину піддають сильному нагріванню (переведення її у стан розрідженого газу) або бомбардують електронами (у газорозрядній трубці). На відміну від суцільних спектрів твердих та рідких тіл і смугастих молекулярних спектрів атомні спектри складаються з окремих ліній, тобто є лінійчастими. Лінійчасті спектри є результатом переходу електронів між різними енергетичними рівнями в атомах або молекулах речовини, що призводить до випромінювання або поглинання електромагнітних хвиль. Частота випромінювання або поглинання ν визначається з рівняння Планка:
hν = E2 – E1,
 де h – стала Планка, E1 – енергія вихідної орбіталі, E2 – енергія орбіталі, на яку перейшов електрон. Якщо атом виділить фотон (квант світлової енергії), то електрон зможе перейти на орбіталь з меншою енергією. У випадку випромінювання великої кількості фотонів, в спектрі з’явиться яскрава лінія; тобто випромінювання атомів зумовлене переходами електронів із стану з більшою енергією E2 у стан з меншою енергією E1. Кожний газ випромінює світло строго визначених довжин хвиль і дає характерний для даного хімічного елемента лінійчастий спектр. Наприклад, у спектрі пари натрію (Na) особливо яскравими є дві жовті лінії. Складено таблиці, в яких перелічуються лінії кожного газу й зазначається яскравість кожної смуги.
де h – стала Планка, E1 – енергія вихідної орбіталі, E2 – енергія орбіталі, на яку перейшов електрон. Якщо атом виділить фотон (квант світлової енергії), то електрон зможе перейти на орбіталь з меншою енергією. У випадку випромінювання великої кількості фотонів, в спектрі з’явиться яскрава лінія; тобто випромінювання атомів зумовлене переходами електронів із стану з більшою енергією E2 у стан з меншою енергією E1. Кожний газ випромінює світло строго визначених довжин хвиль і дає характерний для даного хімічного елемента лінійчастий спектр. Наприклад, у спектрі пари натрію (Na) особливо яскравими є дві жовті лінії. Складено таблиці, в яких перелічуються лінії кожного газу й зазначається яскравість кожної смуги.
 Лінійчасті спектри поглинання (абсорбції) складаються з темних ділянок на фоні неперервного спектра. Вони утворюються в результаті пропускання білого світла крізь речовину. Світло (випромінювання) певних довжин хвиль поглинається речовиною і на цих місцях з’являються темні лінії. Якщо атом поглине фотон, то електрон зможе перейти на орбіталь з більшою енергією; тобто поглинання енергії атомами зумовлене переходами електронів із стану з меншою енергією E2 у стан з більшою енергією E1. У випадку поглинання великої кількості фотонів, в спектрі з’явиться темна лінія. Наприклад, дві темні лінії поглинання пари натрію (Na) містяться в жовтій частині спектра.
Лінійчасті спектри поглинання (абсорбції) складаються з темних ділянок на фоні неперервного спектра. Вони утворюються в результаті пропускання білого світла крізь речовину. Світло (випромінювання) певних довжин хвиль поглинається речовиною і на цих місцях з’являються темні лінії. Якщо атом поглине фотон, то електрон зможе перейти на орбіталь з більшою енергією; тобто поглинання енергії атомами зумовлене переходами електронів із стану з меншою енергією E2 у стан з більшою енергією E1. У випадку поглинання великої кількості фотонів, в спектрі з’явиться темна лінія. Наприклад, дві темні лінії поглинання пари натрію (Na) містяться в жовтій частині спектра.
Спектри випромінювання та поглинання є індивідуальними для кожної речовини, тому їх використовують з метою ідентифікації речовин в науці спектроскопії.
Дослідження спектрів речовин за допомогою спеціальних приладів (спектроскопів) називається спектроскопією, у межах якої здійснюється вимірювання довжин хвиль та інтенсивності ліній у спектрі. Термін „спектрометр” та „спектрофотометр” застосовується до приладів, які працюють в більш широкому діапазоні довжин хвиль: від гамма до інфрачервоного діапазону. Аналіз спектрограми (запису спектра) за положенням ліній та смуг випромінювання і поглинання дозволяє визначити речовини, які спричинюють цей спектр. Світло, що входить у спектрометр, фокусується у тонкий пучок за допомогою щілини або лінзи. Потім промінь проходить або крізь призму (або крізь дифракційну гратку), розкладаючись на спектр. Утворений спектр фокусується на реєструючу матрицю фотокамери. Якщо спектрометр оснащено пристроєм для запису спектра, він називається спектрографом.
Спектрометри, які призначені для вимірювання поглинання електромагнітного випромінювання зразком, містять джерело випромінювання, кювету з речовиною, крізь яку пропускають випромінювання, та детектор. Джерелом випромінювання у таких приладах є стержень, що нагрівається електричним струмом, а детектором – фотоелемент або термопара, які перетворюють, відповідно, світлову або теплову енергію випромінювання в електричний струм. Оскільки скло та кварц поглинають ІЧ‑випромінювання, кювети, дзеркала та призми виготовлені з великих кристалів натрій хлориду. Сучасні спектрометри оснащені цифровими камерами для перегляду в режимі реального часу і сумісні з комп’ютерами.
Cпектральний (спектрографічний, спектрофотометричний) аналіз застосовується у техніко-криміналістичному дослідженні зразків паперу документів, барвників, фармакологічних препаратів, харчових продуктів, компонентів спорядження боєприпасів та слідів пострілу, слідів елементів в металах, сплавах – для виявлення їхнього походження та складу; з метою визначення будови й ідентифікації невідомих органічних сполук: нафтопродуктів, мастил, лакофарбових покриттів, пластмас, полімерів, вибухових речовин, фармпрепаратів, паст кулькових ручок, отруйних речовин подразнюючої дії, наркотичних речовин.
 Хроматографічний аналіз – це фізико-хімічний метод розділення складних сумішей газів, пари, рідин або розчинених речовин на окремі компоненти за допомогою сорбції в динамічних умовах. Цей метод грунтується на різній здатності поглинання компонентів суміші певним вбирачем (сорбентом). Метод разроблено у 1903 році російським ботаніком-біохіміком Михайлом Семеновичем Цвєтом.
Хроматографічний аналіз – це фізико-хімічний метод розділення складних сумішей газів, пари, рідин або розчинених речовин на окремі компоненти за допомогою сорбції в динамічних умовах. Цей метод грунтується на різній здатності поглинання компонентів суміші певним вбирачем (сорбентом). Метод разроблено у 1903 році російським ботаніком-біохіміком Михайлом Семеновичем Цвєтом.
& Назва методу (слово „хроматографія” походить від грецького χρώμα – „колір” та означає „кольорозапис”), пов’язана з першими експериментами з розділення яскраво забарвлених рослинних пігментів.
Перші хроматографічні експерименти М.С.Цвєт здійснив з метою розділення на окремі пігменти хлорофілу – рослинного екстракту, забарвленого в зелений колір. Його досліди базувались на передбаченні того, що хлорофіл є не індивідуальною речовиною, а сумішшю кількох компонентів.
Експеримент полягав у пропусканні екстракту хлорофілу (в органічному розчиннику) крізь скляну трубку, заповнену подрібненою крейдою. Поступово по довжині трубки зверху вниз утворилось шість самостійних кільцевих зон: жовта, жовто‑зелена, темно‑зелена і три жовтих кільця. Найнижче кільце, найбільш віддалене від верхньої частини колонки, належало речовині, яка з кальцій карбонатом сполучалась найменш міцно, і переважну кількість часу її молекули знаходились у розчині. А найближче до входу (верхньої частини) колонки розмістилось кільце з малорухомими молекулами, оскільки вони дуже міцно утримувались кальцій карбонатом. Отримавши на колонці окремі кільцеві зони, Цвєт обережно вичавив вміст колонки зі скляної трубки, вирізав ці кільця і розчинив речовини, адсорбовані на крейді. Потім він легко довів, що хлорофіл є сумішшю двох пігментів – жовто‑зеленого та темно-зеленого. У кільці, забарвленому у жовтий колір, були виявлені також інші рослинні пігменти – ксантофіли. Так було відкрито метод, який дозволив не лише встановлювати якісний склад речовин, але і визначати кількості цих речовин. Забарвлену картину, яка виникає під час розділення компонентів, Цвєт назвав хроматограмою.
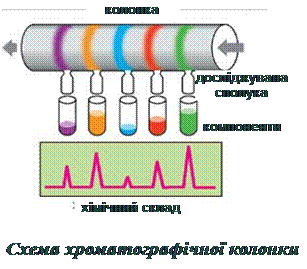 Таким чином, розділення речовин хроматографічним методом полягає у тому, що при пропусканні досліджуваної суміші крізь хроматографічну колонку, окремі компоненти суміші затримуються на різних ділянках колонки і можуть бути виділеними для наступного хімічного аналізу або використання.
Таким чином, розділення речовин хроматографічним методом полягає у тому, що при пропусканні досліджуваної суміші крізь хроматографічну колонку, окремі компоненти суміші затримуються на різних ділянках колонки і можуть бути виділеними для наступного хімічного аналізу або використання.
У 1910‑1930 роки метод практично не розвивався. Важливим етапом стало відкриття Н.А.Ізмайловим і М.С.Шрайбером методу хроматографії в тонкому шарі (тонкошарової хроматографії) в 1938 році в Харківському хіміко‑фармацевтичному інституті. В подальшому важливим в розвитку хроматографії стало відкриття Мартіном і Сингом в 1940 році варіанту рідинної розподільної хроматографії на прикладі розділення похідних амінокислот на колонці, заповненій силікагелем, насиченим водою, з використанням хлороформу в якості розчинника. У 1952 році А.Дж.Мартіну та Р.Сингу було присуджено Нобелівську премію з хімії за створення методу розподільної хроматографії. Потім з’явився надзвичайно простий метод хроматографії на папері.
Будова та принцип роботи сучасного рідинного хроматографа базується на класичній схемі хроматографічної колонки. Через колонку (1), вміщену в термостат, насос повільно прокачує рідину (елюент) з колб. Швидкістю уведення проби і подачі елюента керує електронна система (2). Сигнал від датчиків з колонки реєструється детектором (3), обробляється комп’ютером (4) і може бути роздрукованим у вигляді системи піків – хроматограми.
 |
З середини ХХ століття і дотепер хроматографія інтенсивно розвивається. В наш час вона стала незамінним методом розділення та аналізу складних речовин. Хроматографічним методом можливо разрізнити навіть оптичні ізомери. Для аналізу достатньо декількох міліграмів (10-3 г) суміші, а чутливість даного методу досягає кількох пікограмів (10-12 г). За допомогою хроматографії вдалося, зокрема, вивчити склад та будову білкових сполук, встановити структуру ДНК, одержати багато трансуранових елементів періодичної системи Д.І.Менделєєва, розділяти та очищувати антибіотики, вітаміни, алкалоїди та гормони.
У криміналістиці хроматографічні методи застосовуються при дослідженні багатьох органічних сполук: лікарських препаратів, наркотичних речовин, чорнил, фарб, клеїв, нафтопродуктів. Газова хроматографія особливо ефективна при дослідженні горілчаних виробів, паливо‑мастильних матеріалів, органічних багатокомпонентних розчинників.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1384; Нарушение авторских прав?; Мы поможем в написании вашей работы!