
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Е- l ml с данным l
|
|
|
|
Подуровней Подуровни
Число
n l в уровне в уровне
1 0 1 1 s
2 0, 1 2 2 s, 2 p
3 0, 1, 2 3 3 s, 3 p, 3 d
4 0, 1, 2, 3 4 4 s, 4 p, 4 d, 4 f
Орбитали с l = 0, называются s-орбиталями (облаками) и имеют сферическую форму.

е- с l = 0 → s-электроны.
Орбитали с l = 1 - р-орбитали.

е- с l = 1 → р-электроны
Орбитали с l = 2 - d-орбитали.

е- с l = 2 → d-электроны.
Орбитали с l = 3 - f- орбитали. (см. Интернет).
е- с l = 3 → f- электроны.
3. Магнитное квантовое число (ml) -
величина проекции орбитального момента импульса е- на направление магнитного поля.
· характеризует ориентацию АО в пространстве
· принимает целые значения от – l до + l
· число значений ml = 2 l + 1= числу АО в подуровне = числу
возможных расположений е- - облака данного типа в пространстве.
Число АО
s 0 0 1 ( )
)
p 1 -1, 0, +1 3 (

 )
)
d 2 -2, -1, 0, +1,+2 5 (



 )
)
f 3 -3, -2, -1, 0, +1,+2,+3 7 (





 )
)
Общее число АО (n, l, ml = const) в энергетическом уровне равно n 2.
Вывод: АО полностью определяется набором из 3-х квантовых чисел n, l, ml, т.е. характеризуется определенными размерами, формой и ориентацией в пространстве.
4. Cпиновое квантовое число (ms)
«спин» - от англ. «веретено», «вращаться»
- собственный механический момента импульса е-,
связанный с движением его около своей оси
· принимает значения +1/2 или – 1/2
· обозначается графически  или
или 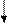
Вывод: Состояние любого е- в атоме может быть полностьюохарактеризовано набором из 4 - х квантовых чисел
Распределение электронов в многоэлектронных атомах.
ОСНОВНЫЕ ПРИНЦИПЫ И ПРАВИЛА
Принцип минимальной энергии
Максимальной устойчивости системы соответствует минимум ее Е. е- вначале заселяют АО с меньшей Е (наиболее близкие к ядру).
1 s < 2 s <2 р < 3 s < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 5 d £ 4 f < 6 p < 7 s и т. д.
увеличение Е
Принцип (запрет)Паули
В атоме не может быть двух е - с одинаковым набором всех 4-х квантовых чисел.
Следствия из принципа Паули
1. На одной АО могут находиться не более двух е-,
отличающихся друг от друга значениями спиновых квантовых чисел.
2. Максимальное число е - на каждом энергетическом уровне Nn = 2 n 2.
3. Максимальное число е - на каждом подуровне Nl = 2(2 l +1).

 n, l – главное и орбитальное квантовые числа
n, l – главное и орбитальное квантовые числа
Правило Гунда
В пределах энергетического подуровня е- располагаются так, чтобы их суммарный спин был максимальным, знак суммы не имеет значения.
Распределение е- в атомах
графическое
в виде формул
Е p
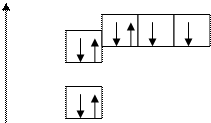 s 8О 1s22s22 p 4
s 8О 1s22s22 p 4
n = 2 или 8О [He]2s22 p 4
8О
n = 1
8О …2s22 p 4
Сокращенная (краткая) е- -формула (или валентная конфигурация) содержит только все внешние е- и е- формирующихся подуровней.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 360; Нарушение авторских прав?; Мы поможем в написании вашей работы!