
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характер изменения свойств атомов и образованных ими простых соединений
|
|
|
|
Валентные свойства атомов
Валентность
· показывает число химических связей, которое может образовать данный атом
· зависит от числа неспаренных е - на внешнем и незавершенных энергетических подуровнях
· в большинстве случаев совпадает с № группы, в которой находится элемент
· различают валентность атома в основном (В) и возбужденном (В*) состояниях
·! Распаривание е - при образовании возбужденных валентностей атома происходит в пределах одного энергетического уровня
Валентность: s - элементы
11Na [Ne] 3 s 1 …3 s 1
12Mg [Ne] 3 s 2 …3 s 2
р - элементы:
О и F: возбужденного состояния нет.
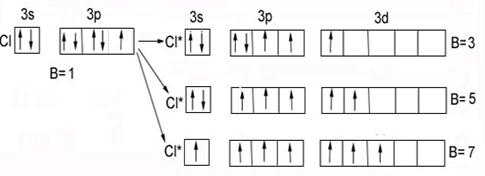
Cl …. 3 s 23 p 5 – электронный аналог фтора.
Валентности:
В = 1,
В*= 3, 5, 7, т.к. имеются свободные 3 d – орбитали.
d - элементы
Для большинства d-элементов валентность в основном состоянии равна 0, т.к. на внешнем уровне нет неспаренных е -.
При переходе в возбужденное состояние s -электроны распариваются. При этом, кроме внешних валентными становятся неспаренные d- электроны предвнешнего подуровня.
27Cо [Ar]3 d 74 s 2 …3 d 74 s 2
Элементы одной подгруппы – аналоги е- - структуры.
s- и р – элементы находятся в главных подгруппах.
d - и f- элементы – в побочных.
в периоде:
ü количество квантовых слоев одинаково
ü заряд ядра ↑слева направо
в этом же направлении:
· Е ионизации (I) валентных е- ↑
· орбитальный радиус атомов (с. 333) ↓
· ↑ окислительные свойства атомов
· ↑ неметаллический характер простых веществ
в подгруппах (вниз по подгруппе):
ü ↑ заряд ядер
ü ↑количество квантовых слоев
Эти тенденции действуют противоположно на величину энергии ионизации I.
Важным фактором становится степень экранирования заряда ядра (предыдущими слоями)
– уменьшение воздействия положительно заряженного ядра на валентные е -.
у атомов элементов главных подгрупп:
ü квантовые слои предыдущие валентным е - заполнены,
ü эффект экранирования сильный
вниз по подгруппе (А):
· энергия ионизации ↓
· орбитальный радиус ↑
· ↑ восстановительные свойства атомов
· ↑ металлический характер простых соединений
у атомов элементов побочных подгрупп (Б):
ü d -оболочка предвнешнего слоя не завершена
ü эффект экранирования относительно слабый
Таким образом,
· энергия ионизации валентных е - у атомов d- и f - элементов в 1.5 – 2 раза выше, чем у атомов s - и p - элементов, стоящих с ними в одном периоде;
· самым сильным восстановителем в этих подгруппах является 2 –ой (сверху) элемент.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 364; Нарушение авторских прав?; Мы поможем в написании вашей работы!