
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
С уменьшением расстояния между частицами
|
|
|
|
Е инд < Е ориен< Е дисп
· Е дисп существует в системе любых молекул
· единственная составляющая вандерваальсовых сил для неполярных молекул
Е В-д-В= Е инд + Е ориен+ Е дисп
ВОДОРОДНАЯ СВЯЗЬ
- связь, образованная положительно поляризованным водородом молекулы А – Н (или полярной группы –А – Н) и электроотрицательным атомом В другой или той же молекулы
А и В- атомы элементов с ↑ ЭО (F,O,N,…)
Поляризованный атом Н:
· отсутствие внутренних ē –оболочек
· значительный сдвиг ē –пары к атому с ↑ ЭО
· малый размер
Þ имеет способность глубоко внедряться в
ē -оболочку  поляризованного атома В
поляризованного атома В
Межмолекулярная Н-связь:
А – Н + В – R ® А – Н×××В – R
Атомы А и В могут быть
одинаковыми: Нd+ – Fd- + Нd+ – Fd- ® H – F … H – F
 Н Н
Н Н
разными: F – H + O ® F – H ··· O
Н Н
Внутримолекулярная Н-связь
· Е н-св возрастает с увеличением ЭО и уменьшением размеров атомов В:
Наиболее прочные связи с элементами 2- го периода:
-Н... F- > -Н... O= > -Н... N≡
кДж/моль 25-42 13-19 8-21
!Несмотря на высокую ЭО у хлора Н - связь – Н…Сl- относительно слабая из-за большого размера атома хлора
· Возникновение Н - связей приводит к образованию димеров, тримеров, полимерных структур (НF)n, кольцевых структур низших карбоновых кислот, спиральных структур белков
· Межмолекулярные Н-связи сильно влияют свойства веществ
и повышают:
- вязкость
- диэлектрическую постоянную
- Т кип и Т плавл
! Н2О, НF и NН3 - аномально высокие Т кип и Т пл.
Донорно – акцепторное межмолекулярное взаимодействие
при взаимодействии одинаковых молекул приводит к образованию
неорганических полимеров (в твердом агрегатном состоянии)
(SiO2) n (AlCl3) n  (BaF2) n
(BaF2) n  неорганические полимеры
неорганические полимеры
при взаимодействии различных по природе молекул приводит к образованию комплексных соединений
CuSO4 + 2NH4OH (СuOH)2SO4 + (NH4)2SO4
(СuOH)2SO4 + (NH4)2SO4
(СuOH)2SO4 + 8NH4OH [Cu(NH3)4](OH)2 + [Cu(NH3)4]SO4 + 8 H2O комплексное комплексная соль
[Cu(NH3)4](OH)2 + [Cu(NH3)4]SO4 + 8 H2O комплексное комплексная соль
основание
|
Теория кристаллического поля
· Для комплексов, в которых КО являются ионы
d – элементов, имеющих от 1 до 9 ē на предвнешнем энергетическом уровне …(n-1) d 1-9
· Лиганды располагаются вокруг КО так, чтобы силы притяжения были максимальны, а силы отталкивания минимальны
· Неспаренные ē комплексообразователя, испытывая отталкивание от ē – пар лигандов с сильным полем, могут спариваться, переходя на более дальние от лигандов d- орбитали.
· Лиганд сильного поля:
ē на d- подуровне КОмаксимально спариваются Þ низкоспиновые комплексы
· Лиганд слабого поля:
спаривания ē на d- подуровне КО не происходит Þ высокоспиновые комплексы
· Для 4- d -и 5- d -элементов – все лиганды сильного поля
· Для 3- d -элементов – спектрохимический ряд лигандов
(в порядке возрастания силы поля):
......................
I–< Br–< Cl– < F– < ОН– < H2O < NCS– < NH3 < NO2– < NC– < CO
Границы между сильным и слабым полями лигандов условны:
лиганд F–: [NiF6]2–– сильное поле
[MnF6]2– – слабое поле
лиганд Н2О [Со(Н2О)6]2+ – сильное поле
[Со(Н2О)6]3+ – слабое поле
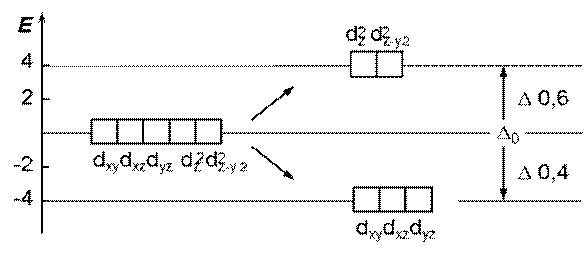
Лиганды влияют на энергетическое состояние d- AО КО.
В отсутствии внешнего электростатического поля все d -орбитали - вырожденные (имеют одинаковую Е)
Под воздействием поля лигандов Þ расщепление d- АО на величину D, называемую энергией расщепления D - зависит от КЧ, природы лигандов и природы КО
Координационное число = 6
октаэдрическое расщепление Е (n -1) d - орбиталей
структура комплекса октаэдр (всегда при к. ч. = 6)
Энергетическая диаграмма расщепления Е (n -1) d - АО
 !
!
Распределение электронов на (n -1) d -орбиталях зависит от силы поля лиганда
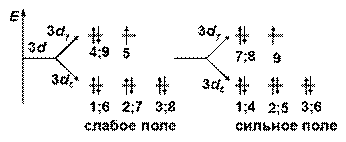
ПРИМЕР Комплекс [Co(Н2О)6]2+
комплексообразователь: Со2+ …3 d 74 s 0
К Ч= 6 Þ октаэдрическое расщепление
комплексообразователь – 3 d – элемент Þ по спектрохимическому ряду: Н2О – лиганд среднего поля,
для Со+2 (низшая степень окисления) он относится к слабым
Энергетическая диаграмма расщепления Е АО d -подуровня

sp 3 d 2-гибридизация
структура комплекса [Со(Н2О)6]2+ – октаэдр
комплекс – высокоспиновый (слабое поле лигандов)
внешнеорбитальный (все лиганды - на внешнем уровне)
! Чаще всего (но не всегда, см. К нест) внешнеорбитальныкомплексы менее проч ные, чем внутриорбитальные
! Магнитные свойства комплекса определяются наличием неспаренных ē на (n-1) d e, g - орбиталях:
если неспаренные ē имеются Þ
комплекс – парамагнетик (слабые магнитные свойства) если неспаренных ē нет Þ комплекс – диамагнетик (нет магнитных свойств)
Со(Н2О)6]2+ – парамагнетик Þ втягивается в магнитное поле
Координационное число = 4
· КО: катион 3 d – металла: в поле слабых лигандов
Þ тетраэдрическое расщепление (см. спектрохимический ряд лигандов)
· КО: катион 4 d - или 5 d - металла Þ все лиганды сильного поля Þ плоско-квадратное расщепление
ПРИМЕР. Комплекс [Au(NH3)4]3+
ü К О: …Au3+ 5 d 86 s 0
ü К Ч = 4
ü К О: 5 d - элемент Þ лиганды сильного поля Þ
плоско-квадратное расщепление
Энергетическая диаграмма расщепления Е АО d -подуровня
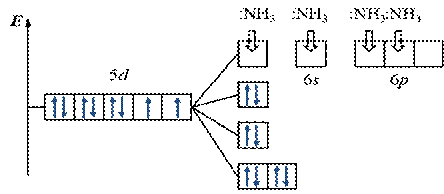
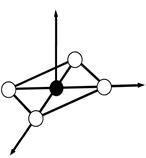
dsp2 - гибридизация АО
структура – плоский квадрат
комплекс:
· внутриорбитальный
· низкоспиновый
· диамагнетик (нет неспаренных ē)
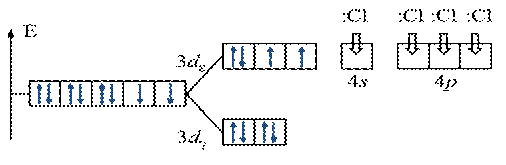
ПРИМЕР. Комплекс [NiCl4]2-
К О: …Ni2+ 3 d 84 s 2
К Ч = 4
КО – 3 d - элемент Þ по спектрохимическому ряду:
Cl- – лиганд слабого поля Þ тетраэдрическое расщепление
Энергетическая диаграмма расщепления Е АО d -подуровня
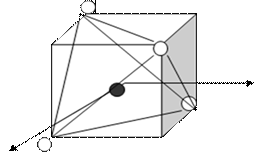
sp 3-гибридизация АО
структура – тетраэдр
комплекс:
высокоспиновый
внешнеорбитальный Þ непрочный
парамагнетик (есть неспаренные ē)
ПРИМЕРЫ
1. Комплекс [AlBr4]-
атом Аl …3 s 23 р 1 (p -элемент)
комплексообразователь: Al3+ …3 s 03 p 0 (акцептор ē – пар)
 лиганды: Br- (доноры ē – пар) Br- …4 s 2 p 6
лиганды: Br- (доноры ē – пар) Br- …4 s 2 p 6
 к.ч. - 4
к.ч. - 4

…3 s 03 p 0 неподеленные ē– пары лигандов
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 569; Нарушение авторских прав?; Мы поможем в написании вашей работы!