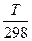КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 9. Энтропия как функцмия состояния системы
|
|
|
|
≈ 95% самопроизвольных реакций идут с выделением тепла
∆ r H< 0.
Но!
растворение многих солей – NH4NO3, NaNO3 и др.
фазовые переходы - испарение, таяние льда; ∆ rH >0:
С + СО2 = 2СО и др. самопроизвольные эндотермические процессы Þ
сведений о тепловом эффекте процесса недостаточно для предсказания его направления!
Переход системы из одного состояния в другое одновременно сопровождается:
ü передачей Е
ü изменением в упорядоченности расположения частиц друг относительно друга
S - энтропия:
мера неупорядоченности (беспорядка) состояния системы
[ S ] = [Дж/(моль.К)]
k – постоянная Больцмана
k = R/N = 1,38 × 10-23 Дж/К
W - термодинамическая вероятность:
- число микросостояний системы, с помощью которых может быть охарактеризовано ее макросостояние
Чем ↑ число микросостояний, тем ↑ вероятность реализации данного макросостояния, тем ↑ энтропия системы.
S = k lnW
1911г. М. Планк 3-ий закон термодинамики:
при абсолютном нуле энтропия идеального кристалла равна нулю (полная упорядоченность)
При Т = 0 К: W = 1, S 0 = 0
! Þ S вещества - абсолютная величина
Стандартная энтропия вещества – S 0 (Дж/моль×К):
энтропия вещества, находящегося в стандартном состоянии.
S 0298 - табулированные величины (см. справочник)
S увеличивается:
ü за счет усложнения состава молекул и ↑ молекулярной массы
S 0298 O O2 O3
Дж/(моль·К) 161 205 238,8
ü при переходе из кристаллического состояния в аморфное
ü с ↑ температуры и концентрации
ü при переходе из более конденсированного состояния в менее конденсированное (скачкообразно)
2-ой закон термодинамики:
вероятность самопроизвольного протекания процессов в изолированной системе определяется ростом энтропии
D S (процесса) > 0 - переход из более упорядоченного состояния в менее упорядоченное - самопроизвольное протекание процесса вероятно (расширение газов, плавление, растворение)
D S (процесса) < 0 – самопроизвольное протекание маловероятно (сжатие газов, конденсация)
ПРИМЕР.
Ст + СО2,г® 2СОг ; D S0 = 87 Дж/К > 0
! увеличение объема системы
3Н2,г + N2,г® 2NH3,г ; D S0 = –90 Дж/ < 0
! уменьшение объема системы
Alк + Sbк = AlSbк; D S0 = –1,1 Дж/К @ 0
! объем системы практически не изменяется
Расчет (изменения) энтропии химической реакции
(следствие из закона Гесса)
Δ r S = ∑ νi S продуктов - ∑ νj S исх. в-в
Δ r S 0298 = ∑ νi S 0298,продуктов – ∑ νj S 0298, исх в-в
– изменение стандартной энтропии реакции при 298 К.
Зависимость Δ r S от температуры:
(в области 298 ÷ Т нет фазовых переходов)
| |||
|
Приближения:
1. Если пренебречь зависимостью Ср вещества от Т
С0рТ = С0 298 и ∆ r Сp о = const
|
3.
|
Задача. Рассчитать ∆ r S0Т реакции:
С(к) + СО2(г) = 2СО(г)
при 298 К и при 1000 К, считая С p(i) = const в рассматриваемом температурном интервале.
Решение.
Вещество S 0298, Дж/(моль.K) С0р 298, Дж/(моль.К)
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 348; Нарушение авторских прав?; Мы поможем в написании вашей работы!
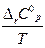 dT
dT
 dT
dT