
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
|
|
|
|
Sp3d2-гибридизация АО
К.ч. - 6
Br-:Br-:Br-:Br- sp3-гибридизация АО

строение комплексного иона
- тетраэдр
2. Комплекс [Sn(OH)6]2-
атом Sn …5 s 25 p 2
комплексообразователь: Sn4+ …5 s 05 p 0 (акцептор ē – пар)
лиганды: OH- (доноры ē – пар)
5 s 5 p 5 d


 …5 s 05 p 0
…5 s 05 p 0



:OH- :OH- :OH- :OH- :OH- :OH-
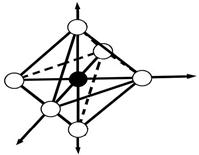 строение комплексного иона - октаэдр
строение комплексного иона - октаэдр
ПРИМЕР. Комплекс [NiCl4]2-
ü К О: …Ni2+ 3 d 84 s 2
ü К Ч = 4
ü КО – 3 d - элемент Þ по спектрохимическому ряду:
Cl- – лиганд слабого поля Þ тетраэдрическое расщепление
Энергетическая диаграмма расщепления Е АО d -подуровня

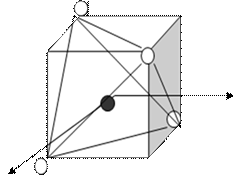
sp 3-гибридизация АО
структура – тетраэдр
комплекс:
высокоспиновый
внешнеорбитальный Þ непрочный
парамагнетик (есть неспаренные ē)
Твердые веществамогут находиться в кристаллическом состоянии (подавляющее большинство)
кристаллические вещества имеют:
· дальний порядок, т.е 3-хмерную
периодичность структуры по всему объему тела
· зависимость свойств от направления в пространстве
(неодинаковы прочность, теплопроводность и т. п.) –
явление анизотропности
· определенную Т пл
хлорид натрия (соль), графит, металлы
в аморфном состоянии (переохлажденные жидкости) аморфные вещества имеют:
· только ближний порядок – упорядоченное расположение частиц на небольших расстояниях
· одинаковые свойства во всех направлениях – явление изотропности
· плавятся не при строго определенной температуре, а в некотором интервале Т
образуются при охлаждении ↓Тзам (кристаллизации нет)
B2O3, GeO2, P4O10, SiO2
Частицы твердого кристаллического тела: атомы, молекулы, ионы.
Положения частиц в кристалле: узлы
Трехмерное расположение узлов: кристалл
Простейшая часть кристалла: элементарная ячейка.
Из 14 типов ячеек наиболее распространенными являются:
ü простая кубическая, ПК
ü гранецентрированная, ГЦК
ü объемноцентрированная, ОЦК
ü гексагональная ГК
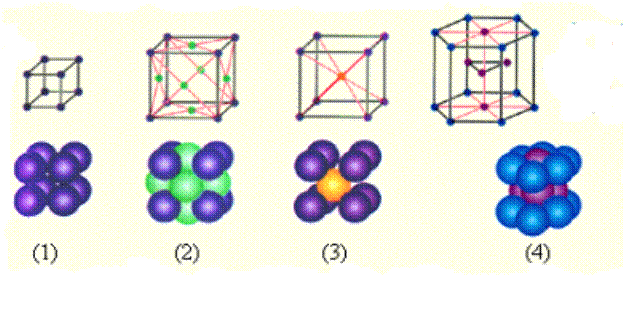
Виды кристаллов и их свойства
Молекулярные кристаллы
В узлах решетки: атомы или молекулы, связанные вандерваальсовами (слабыми) силами
Характеризуются:
· ↓ Е кр
· малой механической прочностью
· ↓ Т пл
· ↑ летучестью
· отсутствием электропроводности (диэлектрики)
↓ теплопроводностью
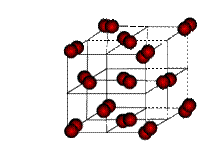 кристаллическая структура I2
кристаллическая структура I2
! Основной вклад величину Е кр вносит энергия химической или межмолекулярной связи между частицами в решетке
¯ Е кр имеют кристаллы благородных газов (Ar, Ne…)и веществ с неполярными молекулами (СН4, СО2, BF3)
между частицами в кристалле:
слабое дисперсионное взаимодействие: Е кр ~ Е дисп
чем ↑α (поляризуемость частицы), тем ↑ Е дисп Þ ↑ Е кр
Е кр ↑ для веществ с полярными молекулами (РСl3, H2S)
м ежду частицами в кристалле:
ориентационное, индукционное и дисперсионное
взаимодействия: Е кр ~ Е ор + Е инд + Е дисп
чем ↑  , тем ↑ Е ор, Е инд Þ ↑ Е кр
, тем ↑ Е ор, Е инд Þ ↑ Е кр
наиболее ↑ Е кр в молекулярных кристаллах с Н- связями
(NH3, H2O)
Е кр ~ Е ор + Е инд + Е дисп + Е Н-св
Атомно-ковалентные кристаллы В узлах решетки:
атомы, связанные ковалентными связями
- немногочисленны
- отдельной структурной единицы выделить нельзя
Характеризуются:
· ↑ Е кр
· высокой механической прочностью
· ↑ Т пл
· ↑ Т кип
· различной электропроводностью:
от диэлектриков: С(алмаз), SiO2 (кварц), BN
до полупроводников: Si, Ge
и даже проводников: Sn (олово серое)
Ионные кристаллы
В узлах решетки: ионы, связанные ионной связью
(KF, NaCl, CaF2, BeO, NaOH, CaCO3)
Характеризуются:
· ↑ Е кр
↑ прочностью (! хрупкие)
· ↑ Т пл
· ↓электропроводимостью (большинство диэлектрики)
! растворы и расплавы проводят электрический ток
· ↓ теплопроводностью
· Кристаллическая решетка
· NaCl

Для 1 моль идеального ионного кристалла
(уравнение Капустинского):
Е ион.кр. ~ 107,13 n ((z +• z - /(R + + R - )) (1)
n – число ионов в формуле кристалла
Металлические кристаллы
В узлах решетки: положительные ионы металлов, связанные металлической связью
(металлы, сплавы)
Характеризуются:
· ↑ электропроводимостью
· ↑ теплопроводностью
· металлическим блеском
· ковкостью и пластичностью
E кр молек кр < E кр металл кр < E кр атом- ков кр
 кристаллическая решетка Na
кристаллическая решетка Na
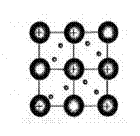 в узлах решетки – катионы Ме,
в узлах решетки – катионы Ме,
погруженные в «электронный газ» -
делокализованные валентные ē
Металлы
с чисто металлической (нелокализованной) связью:
· s, p – металлы и d – металлы с завершенными предвнешними оболочками (нет неспаренных ē)
Характеризуются:
достаточно ↓ E к, достаточно↓ Т пл
с металлическими и ковалентными связями (локализованными):
· d, f – металлы, имеющие неспаренные (валентные) ē
Характеризуются: ↑ E кр, ↑ Т пл, твердостью
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 627; Нарушение авторских прав?; Мы поможем в написании вашей работы!