
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 11. Химическое равновесие
|
|
|
|
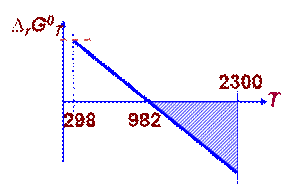
С (графит) 298 – 2300 К
СО2 (г) 298 – 2500 К
СО (г) 298 – 2500 К Þ
искомая область температур: 982 ÷ 2300 К
Состояние системы, при котором энтальпийный и энтропийный факторы уравновешиваются Þ ∆ r GТ = 0
∆ r GТ = ∆ r HТ - T ∆ r SТ = 0 ∆ r HТ = T ∆ r SТ
Þ возможности самопроизвольного протекания прямой и обратной реакции равновероятны Þ парциальные давления и концентрации всех компонентов реакции постоянны во времени и во всех точках системы - равновесные давления и концентрации.
При равновесии химической реакции:
a A(г) + b B(г)+ d D(к) Û e E(г) + f F(г)
Δ r GТ =∆ r G0Т + RT ln 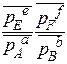 = 0 Þ
= 0 Þ
! под знаком логарифма относительные равновесные давления
∆ r G0Т = -– RT ln 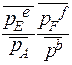
Если реакция a A (р) + b B (р)+ d D (к) Û e E (р) + f F (р) протекает в идеальном растворе:
∆ r G0Т = – RT ln 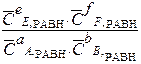
Математическое выражение закона действующих масс (ЗДМ) для равновесного состояния:
Кс = 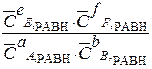
Кр = 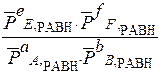
Кс и Кр - константы равновесия
∆ r G0Т = - RT ln Кр для реакций в газовых системах (1)
∆ r G0Т = - RT ln Кс - для реакций в конденсированных системах(1′)
Кр и Кс
ü определяются природой веществ
ü зависят от Т
не зависят от:
ü парциальных давлений
ü концентраций компонентов
ü общего давления в системе
Кр и Кс - характеризуют выход продуктов реакции
Из уравнений (1), (1′) следует:
Δ r G0Т < 0,
если ln Кравн ˃ 0, т.е. Кравн ˃ 1 Þ равновесие смещено вправо
(в равновесной смеси больше продуктов)
Δ r G0Т ˃ 0,
если ln Кравн < 0, т.е. Кравн < 1 Þ равновесие смещено влево
(в равновесной смеси больше исходных веществ)
Соотношение Кр и Кс для газофазной реакции
Парциальные давления газов характеризуют их содержание в реакционной смеси и м.б.заменены на концентрации.
Для реакции:
a A(г) + b B(г)+ d D(к) Û e E(г) + f F(г)
Кр = 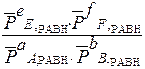 =
=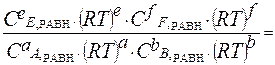
= 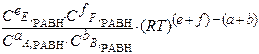
Кр = Кс (RT)∆ν
∆ν = (e + f) – (a + b) – изменение числа молей газов в результате реакции
! R = 0,082 атм.л.моль-1.К-1
Выражение Кр - через равновесные количества молей газообразных компонентов ni ( равн) и общее давление P 0:
pi = 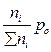 - парциальное давление компонентов
- парциальное давление компонентов
Σni = nE равн + nF равн + nA равн + nB равн
Кр =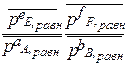 =
= 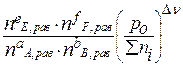
Зависимость константы равновесия от температуры
∆ r G0Т = - RT ln Кр = ∆ r H0 - T ∆ r S0
ln Kp = -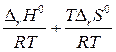 =
=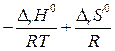 , с учетом ∆ rH0 и ∆ rS0 ¹ f(T)
, с учетом ∆ rH0 и ∆ rS0 ¹ f(T)
уравнение изобары Вант-Гоффа
если ∆ r H 0 < 0 Þ d ln Kp / dT < 0 Þ Кр уменьшается с ↑ Т равновесие смещается влево, в сторону исходных веществ
если ∆ r H 0 > 0 Þ d ln Kp / dT > 0 Þ Кр увеличивается с ↑ Т равновесие смещается вправо, в сторону продуктов реакции
После интегрирования изобары с учетом ∆ r H 0 ¹ f(T) при Т 2 > Т 1:
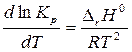
Принцип Ле Шателье
если на систему, находящуюся в истинном равновесии, воздействовать извне, то равновесие смещается в сторону уменьшения эффекта внешнего воздействия
Равновесие смещается:
при ↑ Т Þ в сторону эндотермической реакции
при ↑ Р общего Þ в сторону образования меньшего числа моль газообразных реагентов
при ↑ Р исходных веществ Þ в сторону продуктов реакции
при ↑ С исходных веществ или при ↓ С продуктов реакции Þ в сторону продуктов
ЗАДАЧА
Рассчитайте Кр и Кс реакции
С(к) + СО2(г)  2СО(г)
2СО(г)
при 298 К и 1000 К. Сделайте вывод о выходе продукта реакции и определите знак энтальпии реакции.
Решение:
Кр = 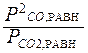 ; Кс =
; Кс = 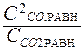
∆ r G 0 Т = – RT ln Кр Þ Kp = exp(– ∆G 0 Т / RT)
∆ r G 0298 = 120,15 кДж; ∆ r G 01000 = –3,16 кДж
Кр 298 = exp(–120 · 103 / 8,31· 298) = ехр(–48,5) = 8 × 10–22
Kp 1000 = exp(+3160 / 8,31 · 1000) = ехр(0,38) = 1,46
(обратите внимание на размерность!)
Кс = 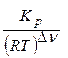 =
= 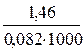 = 0,018
= 0,018
∆ν = 2-1=1 - изменение числа молей газообразных веществ!
При 298 К: Кр ® 0 Þ в равновесной смеси практически отсутствуют продукты Þ смещение равновесия в сторону исходных веществ.
При 1000 К: Кр > 1 Þ в равновесной смеси начинают преобладать продукты, их выход растет с ↑ Т, с ↑ Т значение Кр увеличивается Þ ∆ r H0 >0.
ЗАДАЧА
Определить равновесный состав системы
С(к) + СО2(г)  2СО(г)
2СО(г)
Т = 1000 К Р общ = 2атм nисх, CO2 = 5 моль
Решение:
Реакция идет при P = const!
Kp =exp(- ∆G0Т / RT)
Kp 1000 = exp(+3160/8,31 . 1000)= ехр(0,38) = 1, 46
| Компонент | С | СО2 | 2СО |
| Начальный состав, моль | - | ||
| Изменение состава, моль | - | х | 2 x |
| Равновесный состав, моль | - | 5 – x | 2 x |
Кр =  =
= 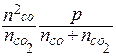 =
=
= 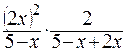 = 1,46 Þ х = 1,7 моль.
= 1,46 Þ х = 1,7 моль.
Равновесный: n (СО2) = 5 - 1,7 = 3,3
состав: n (СО) = 2×1,7 = 3,4.
ЗАДАЧА
Определите сравн СО2 и СО для реакции
С(к) + СО2(г)  2СО(г)
2СО(г)
Т = 1000 К, V сосудa = 2 л, m исх (СО2) = 44 г,
Рассчитайте, на сколько изменится давление в системе при равновесии по сравнению с исходным
Решение:
Реакция идет при V = const!
с СО2 = 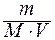 =
= 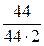 = 0,5 моль/л; Кс, 1000 = 0,018
= 0,5 моль/л; Кс, 1000 = 0,018
Таблица материального баланса:
| Компонент | С | СО2 | 2СО |
| сисх, моль/л | - | 0,5 | |
| Δ с, моль/л | - | х | 2 x |
| сравн, моль/л | - | 0,5 – x | 2 x |
Кс = 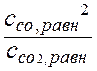 =
= 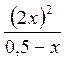 = 0,018 Þ х = 0,0387 моль/л
= 0,018 Þ х = 0,0387 моль/л
с СО, равн = 2. 0,0387 = 0,0774 моль/л
с СО2, равн = 0,5 - 0,0387 = 0,4613 моль/л
Р 0 = сRT = 0,5.0,082•1000 = 41атм
Рравн = (0,5 – х + 2 х) RT = 44,173 атм Þ D Р = 3,173атм
Адсорбция - поглощение одного вещества поверхностью другого вещества
Адсорбция – разновидность сорбции- поглощения одного вещества другим.
Если вещество поглощает всем объемом, то происходит
абсорбция
Адсорбция осуществляется вследствие наличия у поверхностных частиц избыточной поверхностной свободной энергии. Наличие неуравновешенной энергии у поверхностной частицы по сравнению с частицей в объеме приводит к накоплению тех или иных веществ на границе раздела фаз (тв-г, тв-ж, ж-г) т.е. происходит повышение концентрации вещества на границе раздела фаз - адсорбция
Адсорбент - вещество, которое поглощает, адсорбирует
Адсорбат – адсорбированное вещество, которое поглощается.
Десорбция - процесс, обратный адсорбции.
Количественной характеристикой адсорбента является его удельная площадь поверхности S0
S 0 = S / V, м2см-3
S 0= S/ m, м2г-1
Чем больше S0, тем лучше адсорбционная способность адсорбента. Большой S0 обладают активированные угли, цеолиты, алюмосиликаты, силикагель (аморфный кремнезем) – вещества с развитой поверхностью.
S 0 активированного угля достигает величины, равной 400 – 900 м2 г-1
Количественная мера адсорбции адсорбата является величина адсорбции Г - избыток адсорбированного вещества в поверхностном слое и в объеме.
[Г]=[моль/м2]; [моль/см2адсорбента]; [моль/г адсорбента]
Физическая адсорбция
- при взаимодействии адсорбата и адсорбента возникают вандерваальсовы взаимодействия (физическая природа сил); невысокий тепловой эффект (D Н 298 = –(8 – 20)кДж/моль); обратимый процесс - десорбция↑ с ростом Т.
Химическая адсорбция (хемосорбция)
- при взаимодействии адсорбата и адсорбента возникают химические связи (химическая природа сил); тепловой эффект = D Н химических реакций;
необратимый процесс.
Термодинамика адсорбции
Адсорбция протекает самопроизвольно ÞD G адс < 0.При взаимодействии адсорбата с адсорбентом теплота выделяется Þ D Н адс < 0.В процессе адсорбции происходит упорядочение адсорбированных частиц Þ D S адс < 0.
При некоторой температуре Т р наступает равновесие, когда скорость адсорбции равна скорости десорбции υад = υдес
 |
D G адс = 0 и Т р = D Н адс/D S адс.
С увеличением Т адсорбция ↓, десорбция ↑.
Изотерма адсорбции - зависимость адсорбции Г от равновесной концентрации с или равновесного парциального давления р адсорбата при постоянной температуре Г = f (c), Г = f (p)
Наиболее часто используются уравнения Лэнгмюра и Фрейндлиха.
Уравнение Лэнгмюра (предполагает, что поверхность адсорбента однородна и при максимальном заполнении образуется мономолекулярный слой).
Q = Г/Г¥(*) - степень заполнения поверхности адсорбатом.
1- Q - свободная поверхность
Г¥ – максимальная адсорбция (при образовании монослоя);
υад = kад (1- Q) р А – для адсорбции газа на свободной поверхности
υад = kад (1- Q) с А – для адсорбции адсорбата А из раствора
υдес = kдес Q - пропорционально занятой поверхности
При равновесии υад = υдес Þ kад (1- Q) р А = kдес Q
К а = kад/ kдес =Q/(1- Q) р А Þ (*)
или К а = kад/ kдес =Q/(1- Q) с А Þ (*)
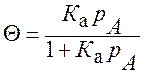 или
или 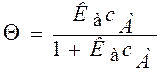 (**)
(**)
Уравнение адсорбции Лэнгмюра имеет вид:
или 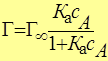

сА – равновесная концентрация адсорбата;
рА – равновесное давление адсорбата;
К а – константа адсорбционного равновесия.
При малых концентрациях и парциальных давлениях адсорбция пропорциональна концентрации или парциальному давлению.
При высоких концентрациях, когда К а× с >> 1, достигается максимальное заполнение Г = Г¥.
Характеристики адсорбента Г¥ и К а находят графически по экспериментальным данным.
Уравнение Лэнгмюра (***) в координатах обратной адсорбции 1/Г и обратной концентрации 1/ с
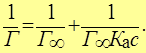
На оси ординат отсекается отрезок, равный 1/Г¥, а tga = 1/(К а×Г¥).
Графическое изображение изотермы адсорбции Лэнгмюра.
(Изотерма Лэнгмюра в двух формах)
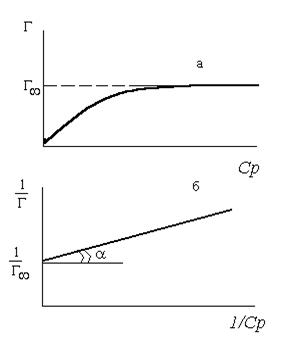
Общие закономерности адсорбции на поверхности твердых тел:
- адсорбция из растворов идет медленнее адсорбции газов,
- адсорбция зависит от природы адсорбента и адсорбата (так, актив. Уголь хорошо адсорбирует газы Cl2, SO2 и не адсорбирует H2O, O2, N2, H2, CO)
- сильнее из растворов адсорбируются вещества с меньшей растворимостью;
- адсорбенты, плохо смачиваемые водой (уголь, тальк)
адсорбируют органические вещества из водных растворов;
- из раствора электролита адсорбируются ионы одного вида.
Применение адсорбции
На этом явлении основаны:
- способы очистки газов и жидкостей от примесей;
- способы разделения смесей газов и жидкостей и анализ компонентов методами хроматографии;
- использование ПАВ (поверхностно активных веществ) в быту и производствах.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 506; Нарушение авторских прав?; Мы поможем в написании вашей работы!