
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентрации растворов
|
|
|
|
Растворы электролитов Растворы неэлектролитов
Жидкие растворы
Ж – Т Ж – Ж Ж – Г
Н2О – NaCl Н2О - С2Н5ОН Н2О - СО2
С2Н5ОН - С12Н22О11 Н2О - Н2SО4 Н2О - НCl
В зависимости от природы растворителя растворы бывают:
Водные Неводные
растворитель – Н2О все другие растворители:
бензол (С6Н6), ацетон (С3Н6О)
По способности проводить электрический ток:
проводят эл. ток не проводят эл. ток
Молярная концентрация, сМ [моль/л, моль/дм3]: количество растворенного вещества в единице объема раствора
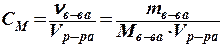
Молярная концентрация эквивалента (нормальная концентрация), с эк [моль/л, моль/дм3]: количество эквивалента растворенного вещества в единице объема раствора
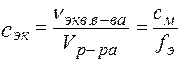
Пример:
C М (Н2SО4) = 2 моль/л Э (Н2SО4) = ½ Н2SО4 Þ
f (Н2SО4) = 1/2 С эк =  = 4 моль/л.
= 4 моль/л.
Всегда численно с эк ˃ с М для многоосновных кислот и многокислотных оснований.
Титр Т [г/мл, г/см3]: масса растворенного вещества (в граммах) в 1 мл раствора
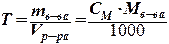
Массовая доля вещества, w (доли или %): отношение массы растворенного вещества к общей массе раствора (показывает, сколько граммов растворенного вещества содержится в 100 г раствора)
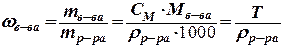
r - плотность раствора [г /мл, г/см3]
Моляльность, cm [моль/кг, моль/1000 г р - ля ]: количество растворенного вещества в 1 кг, или 1000 г растворителя
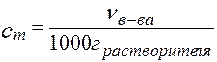
Молярная доля вещества, χi (доли или %): отношение числа молей одного из компонентов раствора (данного вещества) к сумме молей всех компонентов раствора.
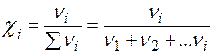
ПРИМЕР. Имеется раствор H3PO4 с массовой долей w = 30% и плотностью r = 1,18 г/см3. Вычислите сМ, с эк, Т, cm иχ H3PO4 в этом растворе.
1. Молярность -?
Масса 1л раствора равна:
m р-ра = r р-ра V р-ра = 1,18×1000 = 1180 г.
В 1 л р-ра:
m (H3PO4) = (m р-ра ∙ w)/100% = (1180×30)/100 = 354 г.
M (H3PO4) = 98 г/моль.
v (H3PO4)= m (H3PO4)/ M (H3PO4) =354/98 = 3,61 моль.
Þ сМ = 3,61 моль/л, (3,61 М H3PO4).
2. Нормальность -?
Э(H3PO4) =1/3 H3PО4, fэ (H3PO4) = 1/3
в 1 моле H3PО4 содержится 3 моль-эквивалента
Þ в 1 л раствора 3,61×3 = 10,83 моль -экв Н3РО4.

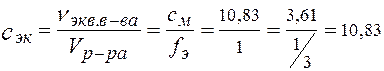 моль/л
моль/л
с эк = 10,83 моль/л, (10,83 н H3PO4).
3. Титр -?
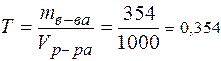 г/мл
г/мл
Т = 0,354 г/мл/
4. Моляльность -?
В 100 г раствора: 30 г Н3РО4 и 70 г Н2О.
В 1000 г Н2О:
m (H3PO4)= (1000×30)/70 = 428,5 г.
v (H3PO4) = m (H3PO4)/ M (H3PO4) = 428,5/98 = 4,37 моля.
Þ сm = 4,37 моль/1000 г Н2О.
5. Молярная доля -?
В 1л раствора:
m (H2O) = 1180 – 354 =826 г.
v (H2O) = m (H2O)/ M (H2O) = 826/18 = 45,89 моль.
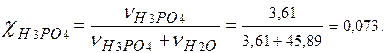
χ (H3PO4 ) = 0,073.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 296; Нарушение авторских прав?; Мы поможем в написании вашей работы!