
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика процесса растворения
|
|
|
|
Растворение - самопроизвольный, обратимый процесс Þ
D G растворения < 0
растворение
 А(к) А(р-р)
А(к) А(р-р)
кристаллизация
(осаждение)
Ненасыщенный раствор – самопроизвольное растворение вещества еще возможно:
D G раств< 0, Jраств > Jосажд
Насыщенный раствор – в данных условиях дальнейшее самопроизвольное растворение невозможно:
DGраств = 0, Jраств = Jосажд
Растворимость вещества (с р) в данных условиях равна концентрации насыщенного раствора в данных условиях. Изменяется в широких пределах.
Абсолютно нерастворимых веществ нет.
Растворимость зависит от:
· природы вещества и растворителя:
«подобное растворяется в подобном»,
· давлениягаза над раствором (если растворяемое вещество газ): закон Генри с р i = kPi,
· температуры:
с ↑ Т растворимость
§ большинства твердых и жидких веществ ↑ (Δ H раств > 0)
§ газообразных и некоторых твердых веществ ↓(Δ H раств < 0)
 Растворение - физико-химический процесс.
Растворение - физико-химический процесс.
Д.И.Менделеев – физико-химическая теория растворов (гидратная (сольватная) теория растворов): взаимодействие растворенного вещества и растворителя
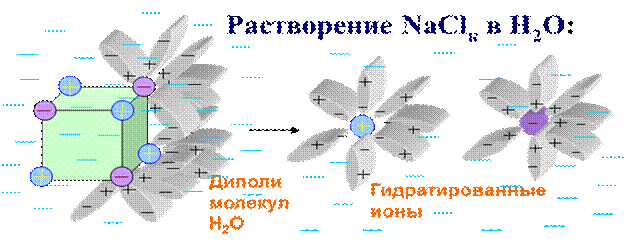 Основные стадии процесса растворения:
Основные стадии процесса растворения:
· процесс ионизации – разрушение связей:
NaClк ® Na+(г) + Cl–(г); D Н ион> 0; D S ион> 0
· процесс сольватации (гидратации) – взаимодействие растворителя с растворяющимся веществом с образованием – сольватов (гидратов):
Na+(г) + aq ® Na+ × aq (р-р)
Cl–(г) + aq ® Cl– × aq (р-р) D Н сольв < 0; D S сольв< 0
· распределение (диффузия) по объему сольватов (гидратов):
D Н дифф > 0, D S дифф > 0
D Н Р = D Н ион + D Н сольв + D Н дифф
D S Р = D S ион + D S сольв + D S дифф
|D Н дифф | << |D Н сольв|,|D Н ион| Þ
Если |D Н ион| < |D Н сольв|:
D Н Р < 0 (экзотермический процесс)
Если |D Н ион| ˃ |D Н сольв|:
D Н Р ˃ 0 (эндотермический процесс)
Как правило, растворение
газов, жидкостей: D Н Р ˃ 0 (|D Н ион|- оч. мала);
твердых веществ: D Н Р < 0
|D Н дифф | << |D Н сольв|,|D Н ион| Þ
Если |D Н ион| < |D Н сольв|:
D Н Р < 0 (экзотермический процесс)
ОБЩИЕ СВОЙСТВА РАСТВОРОВ
зависят от концентрации (числа частиц)
практически не зависят от природы растворенных веществ
проявляются в полной мере в идеальных растворах.
Идеальный раствор:
· между компонентами нет химического взаимодействия
· силы межмолекулярного взаимодействия одинаковы
Þ D Н р = 0, D V р = 0
Реально ≈ очень разбавленные растворы неэлектролитов(с < 0,1 моль/л)
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 446; Нарушение авторских прав?; Мы поможем в написании вашей работы!