
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет рН сильных кислот и оснований
|
|
|
|
Расчет рН слабых кислот и оснований
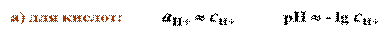
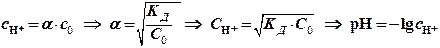
рН = - lg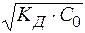
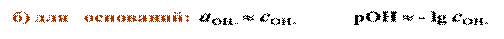
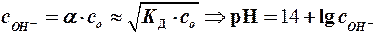
а) для кислот:
I р-ра = 0,5 × å(сi × z 2 i) Þ gН+ (по таблице или формуле)
Þ а Н + = gН+ × с Н+ Þ рН = -lg а Н +
б) для оснований:
I р-ра = 0,5 × å(сi × z 2 i) ÞgOН- (по таблице или формуле)Þ а ОН - = gОН-× с ОН-Þ рН = 14 + lg а ОН-
рН = 14 - рОН =14 + lg а ОН - = 14 + lg gОН-. с ОН-
ЗАДАЧА
Рассчитайте рН 0,05 М раствора НСN.
Решение.
НСN  Н+ + СN-
Н+ + СN-
слабая кислота, с о = 0,05 моль/л, К Д= 7,9×10-10 (из таблицы)
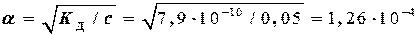 |
a < 0,07 Þ расчет по упрощенной формуле:
с H+ = aсо = 1,26×10-4×0,05 = 6,3×10-6 моль/л
рН = ‑lg с H+ = - lg 6,3×10-6 = 5,18.
ЗАДАЧА
Рассчитайте концентрацию азотистой кислоты НNО2 в растворе с рН = 2,7.
Решение.
НNО2  Н+ + NО2-.
Н+ + NО2-.
слабый электролит, К Д= 4,6×10-4
рН = 2,7 Þ при равновесии
[H+] = [NO2 –] = 10-2,7 моль/л, [HNO2] = (с о - 10-2,7) моль/л
К Д HNO2 = [H+] [NO2–]/ [HNO2] Þ
4,6×10-4 = 10-2,7×10-2,7 / (с о – 10-2,7)
Þ с о =0,00214 моль/л.
ЗАДАЧА. Рассчитайте, как изменится рН 0,05 М раствора КОН при введении в него 0,05 моль/л КCl.
Решение.
1) Расчет рН раствора чистой щелочи.
Сильный электролит:
КОН ® К+ + ОН-
с , моль/л: 0,05 0,05 0,05
I = 1/2(0,05×12 + 0,05×12) = 0,05,
Þ g = 0,85 (по табл. или формуле).
а ОН- = gОН-∙ с OH- = 0,85×0,05 = 0,043
рОН = – lg а ОН- = – lg 0,043 = 1,37.
рН = 14 – 1,37 = 12,63.
2) Расчет рН после добавления соли.
Соль – сильный электролит:
КСl ® К+ + Сl-
с , моль/л: 0,05 0,05 0,05
I = 1/2å сi∙zi 2 = 1/2 (с ОН- z OH-2+ c Na+ z Na+2+ c Cl- z Cl-2+ c K+ z K+2) = 0,1.
Þ gОН- = 0,8, рОН = – lg 0,8×0,05 = – lg 0,04 = 1,4.
рН = 14 – 1,4 = 12,6.
! а ОН-↓ Þ рН ↓ с 12,63 до 12,6.
ЗАДАЧА. Рассчитайте концентрацию основания Ва(ОН)2 в растворе с рН = 11,3; gОН- = 0,965.
Решение. Ва(ОН)2 - щелочь, сильный электролит:
Ва(ОН)2 ® Ва2+ + 2ОН-
с , моль/л: с о с о 2 с о
рОН = 14 - 11,3 = 2,7 Þ а ОН- = 10-2,7 моль/л.
а ОН- = gОН--∙ с OH- Þ с OH- = 10-2,7/0,965 = 0,002 моль/л.
с (Ba(OH)2)= с OH- /2 = 0,002/2 = 0,001 моль/л.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 332; Нарушение авторских прав?; Мы поможем в написании вашей работы!