
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие в растворах комплексных соединений
|
|
|
|
Комплексные соединения диссоциируют в водных растворах как сильные электролиты на внешнюю и внутреннюю сферы (комплексы).
Комплексы, или комплексные ионы, диссоциируют, в свою очередь, как слабые электролиты, причем диссоциация их происходит ступенчато путем последовательного отщепления лигандов.
Константа суммарной реакции диссоциации комплекса К Н называется константой нестойкости и равна произведению констант диссоциации по отдельным ступеням. В общем виде для диссоциации комплекса:
[МХ n ] z Û М n + + n X m
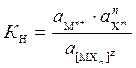 |
где z - заряд комплекса; n + - заряд комплексообразователя; m - заряд лиганда.
Значения констант нестойкости некоторых комплексных ионов табулированы.
Константа процесса, обратного диссоциации комплекса, т. е. процесса образования комплекса, называется константой устойчивости комплекса: К У = 1/ К Н.
Задача.Рассчитайте концентрацию ионов Cu2+ в 0.05 М растворе [Cu(NH3)4]SO4 а) в отсутствие избытка лиганда и б) при наличии избытка аммиака концентрации 1 моль/л.
Решение.а) В соответствии с уравнением диссоциации комплексной соли как сильного электролита:
[Cu(NH3)4]SO4 ® [Cu(NH3)4]2+ + SO42-
концентрация комплексного иона в растворе составит 0,05 моль/л. Константа нестойкости комплексного иона [Cu(NH3)4]2+ для суммарной диссоциации равна 2,14 . 10-13.
Обозначим через х концентрацию Cu2+. Тогда в соответствии с уравнением суммарной диссоциации
[Cu(NH3)4]2+ Û Cu2+ + + 4NH3,
равновесная концентрация аммиака [NH3] равна 4 х, а концентрация недиссоциированного комплексного иона равна (0,05 – х). Поскольку значение К Н очень мало, величиной х по сравнению с 0,05 можно пренебречь. С учетом этого запишем выражение для К Н: К Н =[Cu2+][NH3]4/[Cu(NH3)4]2+ = = x (4 x)4/0,05 = 2,14.10-13. Откуда х = [Cu2+]= 5,3.10-4 моль/л.
б) Концентрацию ионов Cu2+ рассчитываем аналогично, только принимаем [NH3] = 1 моль/л: К Н = х .1/0,05 = 2,14.10-13. Откуда х = 1,07.10-14 моль/л.
Таким образом, в децимолярном растворе аммиака концентрация свободных ионов меди будет более чем на 10 порядков ниже, чем в воде.
Задача.Разрушиться ли комплекс[Ag(NH3)2]+, концентрация которого в растворе составляет 0,1 моль/л, при добавлении раствора NaCl такой же концентрации? (Изменение объема не учитывать).
Решение. Найдем концентрацию свободного иона Ag+ как в примере 15, учитывая, что табличное значение К н=1.10-8. [Ag+]=6,3.10-4. ПР(AgCl) = 1.10-10. ПК = [Ag+][Cl-] = 6,3.10-4. 10-1 = 6,3.10-5 > ПР. Следовательно, выпадет осадок AgCl, равновесие диссоциации комплекса
[Ag(NH3)2]+ Û Cu2++ 4NH3
сместится вправо, в сторону усиления диссоциации и комплекс разрушится.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1855; Нарушение авторских прав?; Мы поможем в написании вашей работы!