
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз расплава NaОН на инертных электродах
|
|
|
|
Ионный состав расплава: NaOH → Na+ + OH- (сильный электролит)
Электроды: графит Ств или Pt – не участвуют в реакциях (инертные)
 К: Na+ + e → Na0 |4 только один процесс
К: Na+ + e → Na0 |4 только один процесс
 А: 4OH- → O2↑ + 2H2O + 4 e только один процесс
А: 4OH- → O2↑ + 2H2O + 4 e только один процесс
4Na++ 4OH- = 4Na0 + O2↑ + 2H2O
По закону Фарадея 
m -масса полученного на катоде натрия; Вi - выход по току
Выходом по току i- го вещества (Вi) называется доля общего
количества электричества (в%), расходуемая на превращение данного вещества.
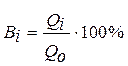
Qi – кол-во электричества, пошедшее на превращение i вещества
Qo – общее кол-во электричества, прошедшее через электрод
Если отсутствуют потери Q на другие процессы ВNa = 100%
Следует помнить: Q A =|Q K |= Q o
ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ
Последовательность протекания электродных процессов зависит от состава электролита, материала электрода, рН, величины поляризации.
Правила катодного восстановления
На катоде в первую очередь восстанавливаются наиболее сильные окислители,
т.е. идет реакция с более + Е. Если разница потенциалов частиц в приэлектродном слое меньше 1В, возможны два и более процесса.
При электролизе окислители делятся на три группы
1.Окислители Е 0ох < < Е 0Н+/Н2
Ионы Ме I A, II A подгупп, стоящих в ряду напряжения выше и вкл. Al на катоде не восстанавливаются, выделяется только Н2.
2. Окислители, Е 0ох > Е 0Н+/Н2
Cu2+, Ag+, Hg2+, Au3+, Pt-Me, O2, и т.д. восстанавливаются в первую очередь,
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 706; Нарушение авторских прав?; Мы поможем в написании вашей работы!