
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
По закону Фарадея
|
|
|
|
Н2 не выделяется
3. Окислители Е 0ох - Е 0Н+/Н2 < 1
Ионы Sn2+, Pb2+, Ni2+, Co2+, Zn2+, Cd2+ и др., стоящие в ряду напряжения между Al и Н2.. Два процесса: Меn+ + ne → Me0, 2H+ + 2 e → H2
Правила анодного окисления
в первую очередь окисляются наиболее сильные восстановители, т.е.идет реакция, потенциал которой наименьший
если разница потенциалов частиц в приэлектродном слое меньше 1В, возможны два и более процесса.
Ионы SO42-, NO3-, NO2-, CO32-, PO43- (анионы кислородсодержащих кислот) на аноде не окисляются!!!
В случае электролиза раствора Na2SO4 (электроды Pt)
[- K]: 2Н+ + 2 е → Н2↑
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4 е один процесс на аноде
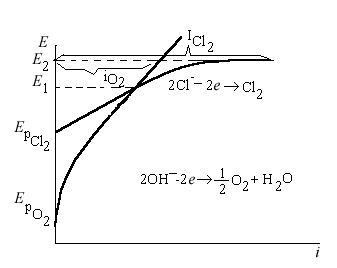
В случае электролиза раствора NaCl (электроды Pt)
[- K]: 2Н+ + 2 е → Н2↑
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4 е два процесса на аноде
2Cl- → Cl2 ↑ + 2 е
Задача.
Рассмотрите электролиз раствора Na2SO4на растворимых Ni-электродах. Напишите уравнения процессов электролиза. Рассчитайте массы и объемы выделившихся газов (приведенные к н.у.), которые образуются на электродах за 0,2 часа при токе 5А. Вi (О2)=60%.
Решение.Ионный состав раствора:
Na2SO4 ж → 2Na+p + SO42-p
Н2Ож ↔ Н+р + ОН-р
(соль образована сил. осн. и сильн. кислотой нет гидролиза)рН = 7
Равновесные потенциалы возможных электродных процессов
[- K]: Е0Na+/ Na = - 2,9 В ЕрН+/Н2 = - 0,059рН = -0,41 В
[+A]: SO42- - не окисляется, ЕрО2/ОН- =1,23-0,059рН=0,82 В
Е0Ni2+/ Ni = - 0,025 В Þ ∆ E < 1 Þ два процесса
[- K ]: 2Н+ + 2 е → Н2↑ 100%
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4 е 60%
Ni0 → Ni2+ + 2 e 40%
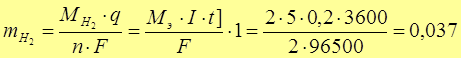 г
г 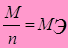
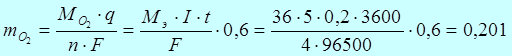 г
г
Рассчитаем объем (при н.у. 1 моль газа V0m = 22,4 л)
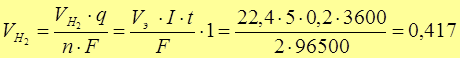 л
л 
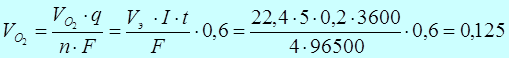 л
л
Применение электролиза
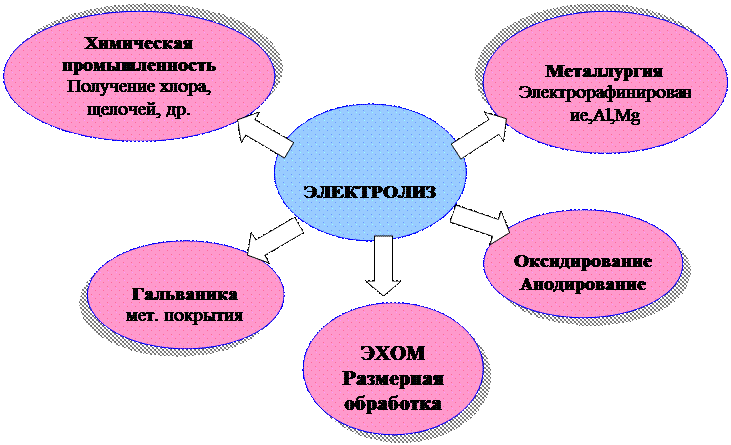
Гальванотехника включает гальваностегию и гальванопластику
1. Гальваностегия – нанесение металлических покрытий на поверхность изделия путем электролиза (никелирование, меднение, хромирование и др.)
. Электролит – водный раствор соли металла, кот. наносят.
 Изделие Þ катод Анод Þ металл покрытия
Изделие Þ катод Анод Þ металл покрытия
[+A]: Мепокр → Меn+р-р + n e
[- K]: Меn+р-р + n e → Мепокр
· Защита от коррозии
· Защитно-декоративное
· Повышение электропроводности
· Повышение твердости и износостойкости
· Получение магнитных пленок
· Уменьшение коэффициента трения
· Улучшение способности к пайке
· Улучшение отражательной способности поверхности
Пример.Электрохимическое никелирование.
Напишите уравнения катодного и анодного процессов. Предложите материал анода и электролит. Обоснуйте выбор.
Рассчитайте массу и толщину никелевого покрытия на стальном изделии поверхностью 1 м2 и изменение массы и толщины Ni -анода поверхностью 1 м2 при э/х никелировании в течение 1 ч из водного раствора на основе NiSO4, если катодная плотность тока – 100 А/м2, а анодная – 50 А/м2. Выход по току Ni на катоде – 80%, а на аноде – 90%. Плотность Ni ρ=8,9 г/см3. (Гидролизом пренебречь, рН≈7).
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 509; Нарушение авторских прав?; Мы поможем в написании вашей работы!