
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция № 20. Электролиз
|
|
|
|
К А
Еа = Е0 Н+/Н2 = 0 Þ Еэ = Ек - Еа = ЕМn+/М
Задача.
Напишите катодные и анодные процессы, протекающие при работе цинк - серебряного ГЭ, рассчитайте Е 0Э при Т = 298 К двумя способами и Е Э, если а Zn2+ = а Ag+ = 0,01 моль/л.
Решение.Из таблицы стандартных потенциалов:
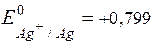 В,
В,  В.
В.
Т.к. 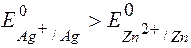 Þ
Þ
Zn – анод (окисление - е -).
Ag – катод (восстановление, + е -),
 |
А: Zn ® Zn+2 + 2e
K: Ag+ + e ® Ag 2 (баланс по е -)
 ТОР: Zn + 2Ag+
ТОР: Zn + 2Ag+  Zn+2 + 2Ag
Zn+2 + 2Ag
Расчет стандартной ЭДС ГЭ
1)  =
=
= 0,799 – (– 0,763) = 1,562 В
2) 
 = 1,561B.
= 1,561B.
Расчет равновесных нестандартных потенциалов металлических электродов
 B
B
 В
В
Расчет нестандартной ЭДС ГЭ
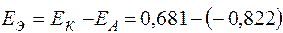 = +1,503 В ЕЭ0 > ЕЭ
= +1,503 В ЕЭ0 > ЕЭ
КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
Электродные реакции - гетерогенные
i = I / S -плотность тока [A/M2], [MA/cM2]
Величина плотности тока – количественная характеристика скорости электрохимической реакции
Графики зависимости Е =f(i) – поляризационные кривые
Поляризация D Е: отклонение потенциала электрода подтоком Еi от его равновесного значения Еp
D Е = Еi – Еp
D ЕA = ЕAi – ЕAp анодная поляризация
D ЕK = ЕKi – ЕKp катодная поляризация
Поляризационные кривые ГЭ
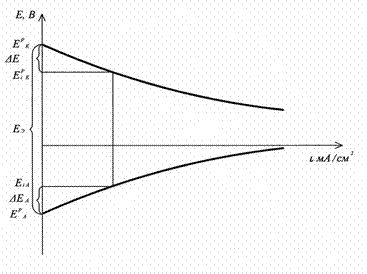
За счет поляризации (независимо от знака электрода):
Е а Þ более положительным,
Е к Þ более отрицательным
Чем ↑ v электрохимической реакции (величина тока), тем больше потери напряжения (U)

ЕЭ – ЭДС ГЭ;
I(r 1 + r 2 ) - омическое падение напряжения;
r 1 - сопротивлениев проводниках I рода (e- - проводимость) - мало;
r 2 - сопротивление в электролите (проводник II рода, ионная проводимость).
С ростом I и D Е напряжение U - уменьшается
Основные стадии электрохимической реакции:
1. Подвод реагентов к электроду (массоперенос)
2. Собственно электрохимический разряд (перенос е - от частицы на электрод и наоборот)
3. Отвод продуктов реакции от электрода (массоперенос)
Самая медленная стадия лимитирует v всего процесса
Ox + n e  Red
Red
А
ЗДМ для катодного и анодного процессов:
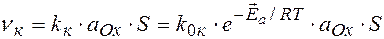

Причины замедленности реакции:
↓ а частиц или ↑ Е а процессов.
Если электродная реакция замедленна из-за:
↑ Е а, поляризация называется электрохимической (∆ Е эх) или перенапряжением
↓ а (конц-и) исходных веществ, либо ↑ а (концентрации)
Электрохимическая поляризация (перенапряжение)
Связь между ∆ Е эх и i (плотностью тока) -
уравнение Тафеля:
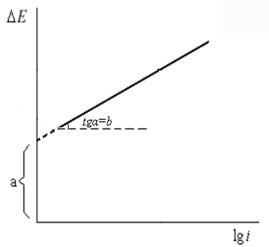
D Е эх = а + вlgi
в – const, при Т = 298 К: 0,03 – 0,15 В (чаще 0,1 -0,12 В)
зависит:
ü от природы реакции
ü Т
А – const, при Т = 298 К: 0,0 – 2,0 В
зависит:
ü от природы реакции
ü материала электрода
ü Т
ü состава электролита
Физический смысл а: это величина ∆ Е эх при i =1 А/м2
Зависимость электрохимической поляризации электродов от lg i
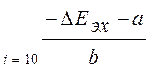
Концентрационная поляризация
Обусловлена замедленностью подводов реагентов к поверхности электрода и отводом продуктов реакции в электролит

а s,v – активность ионов в приэлектродном слое(s) или в объеме раствора (v) Так, в Zn – Cu г.э. Е а смещается в +сторону, Е к – в – сторону, из-за Сv не равного Сs
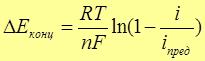
D – коэффициент диффузии реагента
d - толщина диффузионного слоя (тонкий слой около поверхности,где частицы переносятся путем диффузии)
D Е конц уменьшается, если:


 1) D; 2) Сv; 3) d; 4) перемешивать электролит
1) D; 2) Сv; 3) d; 4) перемешивать электролит
ЭЛЕКТРОЛИЗ – процесс превращения электрической энергии в химическую

Электролизер – прибор, в котором проходит
электролиз:
1. Катод- 
Анод – 
2. электролит
3. источник постоянного тока
Электроды:
 Инертные Активные –
Инертные Активные –
(неактивные) все М электроды.
Pt-мет., C, Аu, PbО2, RuO, Они растворяются на аноде:
нерж. cталь - не растворяютсяМ→ Мn+ + nе
Металлы, переходящие в определенной среде в неактивное состояние, т.е. пассивирующиеся, благодаря образованию защитной пленки (оксидов, гидроксидов, солей) на поверхности –алюминий, никель, хром, титан, тантал и нек. др.)
Электролиз подчиняется законам Фарадея и кинетическим законам. Для принудительного процесса (не протекающего самопроизвольно в прямом направлении):
А min = D G D G = nFU min U min = Е а - E K
Потенциал разложения или выделения: минимальное напряжение, при котором процесс электролиза становится возможным.
Под действием тока потенциалы электродов электролизера изменяютcя
– поляризация: Е К – более отрицательным, Е А – более положительным
Клемовое напряжение (напряжение электролизера) вследствие поляризации
и омических потерь увеличивается с увеличением i
Uкл=Umin + ∆EA + ∆EK + I(R1+R2)
Увеличение Uк л приводит к перерасходу энергии по сравнению с рассчитанной по уравнениям химической термодинамики
Для уменьшения U кл следует:
1. для ↓ омических потерь:
- использовать электролит с высокой электропроводностью
- уменьшить расстояние между электродами
- ↑ Т;
2. для ↓ концентрационной и э/х поляризации:
- ↑ S э лектродов ; ↑ Т;изм. Среагента;
- перемешивать;
- использовать электроды-катализаторы;
- ↓ ток
Пример 1.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 563; Нарушение авторских прав?; Мы поможем в написании вашей работы!