
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Малорастворимых сильных электролитов
|
|
|
|
ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ ВРАСТВОРАХ
Ag+ + Cl- → AgCl↓
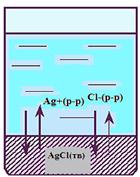 В насыщенных растворах сильных электролитов - равновесие между твердой фазой и ионами в р - ре:
В насыщенных растворах сильных электролитов - равновесие между твердой фазой и ионами в р - ре:
АgCl(тв)  Ag+(p-р) + Cl-(p-р)
Ag+(p-р) + Cl-(p-р)
- гетерогенный процесс
Соли – сильные электролиты Þ та часть соли, которая растворилась полностью диссоциирована на ионы:
АgCl(тв) → Ag+(p-р) + Cl-(p-р)
с Р с Р с Р моль/л
Растворимость C Р - концентрация насыщенного раствора электролита при данной Т
Для гетерогенного процесса:
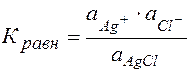 ,
, 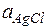 = 1 (тв. вещество) Þ
= 1 (тв. вещество) Þ
Кравн = 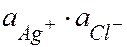 = ПР
= ПР
ПР – произведение растворимости:
произведение а ионов, содержащихся в насыщенном растворе электролита, в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при Т = const
В общем виде:
А n B m (т)  n A m +(н.p) + m B n -(н.p)
n A m +(н.p) + m B n -(н.p)
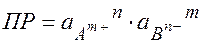
ПР зависит от природы электролита и растворителя, T
не зависит от а ионов
ПР 25 С – табулированы
Условие образования осадка:
Если (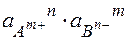 ) ³ ПР табл – осадок выпадает
) ³ ПР табл – осадок выпадает
Если (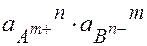 ) < ПР табл – осадок не выпадает
) < ПР табл – осадок не выпадает
ЗАДАЧА. Можно ли приготовить раствор Са(ОН)2 концентрации с = 2.10-3 моль/л? ПР Са(ОН)2 = 6.10-6
Решение.
Ионная сила раствора:
I = ½(c Ca2+∙ z 2Ca2+ + c OH- ∙ z 2OH-) = 8.10-3
коэффициенты активности (из таблицы):
gСа2+ ≈ 0,61 gОН- ≈ 0,93
ПА в растворе требуемой концентрации:
ПА = а Са2+∙ (а ОН-)2 = 0,61.2.10-3∙(0,93.4.10-3)2 = 1,69.10-8
ПА < ПРтабл Þ раствор заданной С можно приготовить.
Зная ПР, можно рассчитать растворимость сР [моль/л], [ г/л],[г/моль] и наоборот
А n B m (т)  n A m +(н.p) + m B n -(н.р)
n A m +(н.p) + m B n -(н.р)
с Р nс Р mс Р моль/л
ПР = = (gА m+×n × с Р) n × (gB n-×m ×с Р) m= ( gА m+)n ×( gB n-)m × nn × mm ×(с Р) n+m
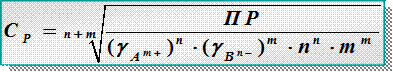
– растворимость труднорастворимого сильного электролита
если g ® 1

ЗАДАЧА. Определите с Р MgF2. ПР(MgF2) = 4×10-9
Решение:
MgF2 (т)  Mg2+(н.р) + 2F-(н.р)
Mg2+(н.р) + 2F-(н.р)
Значение ПР мало, g ® 1, a Ba2+» [Ba2+] и a F-» [F–].
ПР(MgF2) = 4×10-9 = 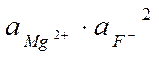 n =2, m =1
n =2, m =1
сР = 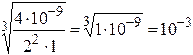 моль/л
моль/л
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 917; Нарушение авторских прав?; Мы поможем в написании вашей работы!