
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция № 16. Равновесия в растворах электролитов
|
|
|
|
ГИДРОЛИЗ СОЛЕЙ
- реакции обмена между молекулами воды и ионами соли с образованием слабых электролитов.
Процесс гидролиза:
· обратный реакции нейтрализации
· эндотермический, Δ Н Г>0 (всегда)
· в большинстве случаев – обратим
· сопровождается изменением рН раствора соли
· 4 типа солей
·
· Соли, образованные сильным основанием и сильной кислотой
(Na2SO4, KI, NaВr, СsCl, RbNО3 и т. п.)
- гидролизу не подвергаются
Na2SO4 ® Na+ + SO42-


NaOH H2SO4
сильное основание сильная кислота
среда нейтральная: рН = 7
2) Соли, образованные слабым основанием и сильной кислотой
– гидролиз по катиону
(NH4Cl, AgNO3, AlBr3, CuSO4 и т. п.)
Диссоциация соли: NH4Cl ® NH4+ + Cl–


NH4ОН HCl
слабое основание сильная кислота
Гидролиз – по слабому иону:
NH4+ + НОН  NH4ОН + Н+
NH4ОН + Н+
Н+ОН- кислая среда, рН < 7
Гидролиз многозарядных ионов протекает ступенчато:
Диссоциация соли: Zn(NO3)2 ® Zn2+ + NO3–


Zn(ОН)2 HNO3
слабое основание сильная кислота
Гидролиз – по слабому иону:
I ступень гидролиза: Zn2+ + НОН  ZnОН+ + Н+
ZnОН+ + Н+
|
 кислая среда, рН < 7
кислая среда, рН < 7
! Раствор – электронейтральная система:
зарядность в левой и правой частях уравнения одинакова
В обычных условиях (Т комн, не слишком разбавленный раствор) гидролиз идет только по I ступени
Усилить гидролиз (сместить гидролитическое равновесие →)
можно:
· разбавлением (↑ С Н2О)
· ↑ Т (эндотермическая реакция, Δ Н Г > 0)
· удалением продуктов гидролиза из сферы реакции (связывание ионов Н+ и ОН-)
СN- + НОН  НСN + ОН-
НСN + ОН-
НСl ® Cl- + H+
Н+ + ОН- Н2О
Н2О
II ступень гидролиза: ZnОН+ + НОН → Zn(ОН)2 ↓+ Н+
кислая среда, рН ↓
Если в результате гидролиза образуются малорастворимые или газообразные вещества Þ гидролиз необратимый
3) Соли, образованные сильным основанием и слабой кислотой
– гидролиз по аниону
(К2SiO3, Na2S, Ba(СН3СОО)2 и т. п.)
Диссоциация соли: Na2S ® 2Na+ + S2-


NaOH H2S
сильное основание слабая кислота
Гидролиз – по слабому иону:
I cт.: S2- + HOН  HS- + ОН-
HS- + ОН-
|
 щелочная среда, рН > 7
щелочная среда, рН > 7
II ст.: HS- + HOН  H2S + ОН- рН ↑
H2S + ОН- рН ↑
4) Соли, образованные слабым основанием и слабой кислотой
– гидролиз по катиону и аниону
(NН4СN, РbCO3, Аl2S3 и т. п.)
Диссоциация соли: NН4СN → NН4+ + CN-


NH4ОН HCN
слабое основание слабая кислота
Гидролиз – по слабым ионам:
NН4+ + СN- + Н2О  NН4ОН + НСN
NН4ОН + НСN
|

Растворы таких солей могут быть кислыми, нейтральными или щелочными в зависимости от соотношения К Д слабых электролитов, образующихся при гидролизе.
К Д NH4OH = 1,8 ∙ 10 -5 , К Д HCN = 7,9 ∙ 10 -10
К Д NH4OH ˃ К Д HCN Þ рН > 7, слабощелочная среда
Количественная характеристика гидролиза - степень гидролиза b-
- отношение концентрации гидролизованных ионов соли к исходной концентрации соли

b £ 1 а иона ≈ с иона
Гидролиз – обратимый равновесный процесс:
NH4+ + НОН  NH4ОН + Н+
NH4ОН + Н+
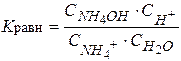
 - константа гидролиза
- константа гидролиза
х числитель и знаменатель на С ОН-


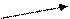 К W
К W

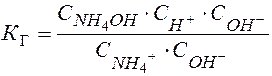
К Д NH4OH
Þ 
В общем случае:
К Г иона соли по определенной ступени равна ионному произведению воды, деленному на К Д слабого электролита, образующегося на данной ступени гидролиза.
Диссоциация: Na2S ® 2Na+ + S2-
Гидролиз:
I cт. S2- + HOН  HS- + ОН-
HS- + ОН-
II ст. HS- + HOН  H2S + ОН-
H2S + ОН-
Выражения К Г через равновесные С ионов:
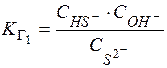

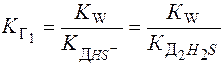
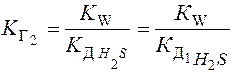
Диссоциация H2S:
I ст. H2S HS- +Н+
HS- +Н+
II ст. HS-  S2- + Н+
S2- + Н+
К Г1=10-14/10-14 = 1 К Г2=10-14/1,1.10-7 = 9,1.10-8
К Г1>> К Г2 (всегда) Þ
все количественные расчеты по I ступени!
Для соли, образованной слабой кислотой и слабым основании 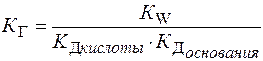
Чем ↓ К Д продукта гидролиза, тем ↑ К Г
К Г зависит:
от Т (сильно), с ↑ Т ↑ К Г (D Н Г < 0)
от природы гидролизующегося иона
не зависит от концентрации
Связь между b и К Г (аналогично закону Оствальда):
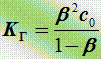
Если b << 1 
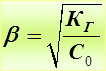
Расчет рН растворов солей с гидролизом по аниону:
ЗАДАЧА.
Рассчитайте К Г, b и рН 0,01 М раствора К2SО3.
Решение.
Диссоциация сильного электролита К2SО3:
со 2 со со
К2SО3 ® 2К+ + SО32-
 |  | ||
КОН Н2SО3
сильное основание слабая кислота
Гидролиз по SО32- (слабый ион):
I ст.: SО32-+ НОН  НSО3-+ ОН- щелочная среда
НSО3-+ ОН- щелочная среда
с равн: c 0 - х х х
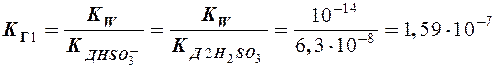
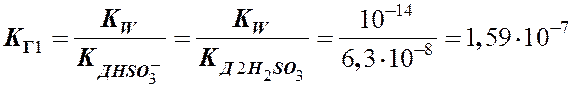 II ст.: НSО3- + Н2О
II ст.: НSО3- + Н2О  Н2SО3 + ОН-
Н2SО3 + ОН-
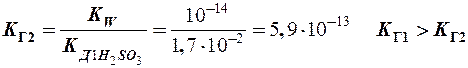 |
Þ расчет по I ступени гидролиза
I способ - через материальный баланс:
SО32-+ НОН  НSО3-+ ОН-
НSО3-+ ОН-
| SO32- | НSO3- | OН- | |
| c исход | со | ||
| D c | x | x | x |
| c равн | с о - x | x | x |
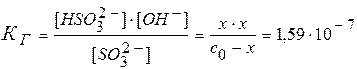
Þ x = [ОН-] = 4×10-5 моль/л
pOH = -lg[ОН-] = 4,4 pH = 14 - 4,4 = 9,6
II способ - через степень гидролиза:

 рОН = - lg C OH- = -lg 4 ∙ 10 -5 = 4,4
рОН = - lg C OH- = -lg 4 ∙ 10 -5 = 4,4
рН = 14 – рОН = 14 – 4,4 = 9,6 рН ˃ 7
Расчет рН растворов солей с гидролизом по катиону:
ЗАДАЧА. Рассчитайте рН 0.5 М раствора АlСl3, учитывая только 1-ю ступень гидролиза.
Решение.
со со 3 со
Диссоциация соли: АlСl3 ® Аl3+ + 3Сl-
 |  | ||
Al(ОН) 3 НCl
слабое основание сильная кислота
Гидролиз по Аl3+ (слабый ион):
I ст. Аl3+ + Н2О  АlОН2+ + Н+ кислая среда
АlОН2+ + Н+ кислая среда
с равн: c 0 - х х х
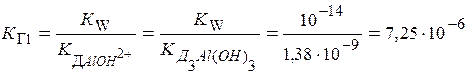
К Г очень мало (<10-4) Þ
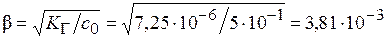 |
b << 1 Þ расчет по приближенной формуле правомерен
[H+] = [AlOH2+] = bc 0= 3,81×10-3×0,5 = 1,91×10-3.
Þ рН = – lg [H+] = – lg 1,91×10-3 = 2,6. рН < 7
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1023; Нарушение авторских прав?; Мы поможем в написании вашей работы!