
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
КУРС ФИЗИКИ 9 страница
|
|
|
|
 (48.7)
(48.7)
Из сопоставления формул (48.1), (48.3) и (48.6), описывающих явления переноса, следует, что закономерности всех явлений переноса сходны между собой. Эти законы были установлены задолго до того, как они были обоснованы и выведены из молекулярно-кинетической теории, позволившей установить, что внешнее сходство их математических выражений обусловлено общностью лежащего в основе явлений теплопроводности, диффузии и внутреннего трения молекулярного механизма перемешивания молекул в процессе их хаотического движения и столкновений друг с другом.
Рассмотренные законы Фурье, Фика и Ньютона не вскрывают молекулярно-кинетического смысла коэффициентов l, D и h. Выражения для коэффициентов переноса выводятся из кинетической теории. Они записаны без вывода, так как строгое рассмотрение явлений переноса довольно громоздко, а качественное — не имеет смысла. Формулы (48.2), (48.4) и (48.7) связывают коэффициенты переноса и характеристики теплового движения молекул. Из этих формул вытекают простые зависимости между l, D и h:
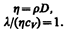
Используя эти формулы, можно по найденным из опыта одним величинам определить другие.
§ 48. Вакуум и методы его получения. Свойства ультраразреженных газов
Если из сосуда откачивать газ, то по мере понижения давления число столкновений молекул друг с другом уменьшается, что приводит к увеличению их длины свободного пробега. При достаточно большом разрежении столкновения между молекулами относительно редки, поэтому основную роль играют столкновения молекул со стенками сосуда. Вакуумом называется состояние газа, при котором средняя длина свободного пробега < l > сравнима или больше характерного линейного размера d сосуда, в котором газ находится. В зависимости от соотношения < l > и d различают низкий (< l > << d), средний (< l > £ d), высокий (< l > > d) и сверхвысокий (< l > >> d) вакуум. Газ в состоянии высокого вакуума называется ультраразреженным.
Вопросы создания вакуума имеют большое значение в технике, так как, например, во многих современных электронных приборах используются электронные пучки, формирование которых возможно лишь в условиях вакуума. Для получения различных степеней разрежения применяются вакуумные насосы. В настоящее время применяются вакуумные насосы, позволяющие получить предварительное разрежение (форвакуум) до»0,13 Па, а также вакуумные насосы и лабораторные приспособления, позволяющие получить давление до 13,3 мкПа — 1,33 пПа (10–7 —10–14 мм рт. ст.).
Принцип работы форвакуумного насоса представлен на рис. 72. Внутри цилиндрической полости корпуса вращается эксцентрично насаженный цилиндр. Две лопасти 1 и 1', вставленные в разрез цилиндра и раздвигаемые пружиной 2, разделяют пространство между цилиндром и стенкой полости на две части. Газ из откачиваемого сосуда поступает в область 3, по мере поворачивания цилиндра лопасть 1 отходит, пространство 3 увеличивается и газ засасывается через трубку 4. При дальнейшем вращении лопасть 1' отключает пространство 3 от трубки 4 и начинает вытеснять газ через клапан 5 наружу. Весь процесс непрерывно повторяется.

Для получения высокого вакуума применяются диффузионные насосы (рабочее вещество — ртуть или масло), которые не способны откачивать газ из сосудов начиная с атмосферного давления, но способны создавать добавочную разность давлений, поэтому их употребляют вместе с форвакуумными насосами. Рассмотрим схему действия диффузионного насоса (рис. 73). В колбе ртуть нагревается, пары ртути, поднимаясь по трубке 1, вырываются из сопла 2 с большой скоростью, увлекая за собой молекулы газа из откачиваемого сосуда (в нем создан предварительный вакуум). Эти пары, попадая затем в «водяную рубашку», конденсируются и стекают обратно в резервуар, а захваченный газ выходит в пространство (через трубку 3), в котором уже создан форвакуум. Если применять многоступенчатые насосы (несколько сопл расположены последовательно), то реально при хороших уплотнениях можно с помощью них получить разрежение до 10–7 мм рт. ст.
Для дальнейшего понижения давления применяются так называемые «ловушки». Между диффузионным насосом и откачиваемым объектом располагают специально изогнутое колено (1 или 2) соединительной трубки (ловушку), которую охлаждают жидким азотом (рис. 74). При такой температуре пары ртути (масла) вымораживаются и давление в откачиваемом сосуде понижается приблизительно на 1—2 порядка. Описанные ловушки называют охлаждаемыми; можно применять также неохлаждаемые ловушки. Специальное рабочее вещество (например, алюмогель) помещают в один из отростков соединительной трубка вблизи откачиваемого объекта, которое поддерживается при температуре 300°С. При достижении высокого вакуума алюмогель охлаждается до комнатной температуры, при которой он начинает поглощать имеющиеся в системе пары. Преимущество этих ловушек состоит в том, что с их помощью в откачиваемых объектах можно поддерживать высокий вакуум уже после непосредственной откачки в течение даже нескольких суток.
Остановимся на некоторых свойствах ультраразреженных газов. Так как в состоянии ультраразрежения молекулы практически друг с другом не сталкиваются, то газ в этом состоянии не обладает внутренним трением. Отсутствие соударений между молекулами разреженного газа отражается также на механизме теплопроводности. Если при обычных давлениях перенос энергии молекулами производится «эстафетой», то при ультраразрежении каждая молекула сама должна перенести энергию от одной стенки сосуда к другой. Явление уменьшения теплопроводности вакуума при понижении давления используется на практике для создания тепловой изоляции. Например, для уменьшения теплообмена между телом и окружающей средой тело помещают в сосуд Дьюара*, имеющий двойные стенки, между которыми находится разреженный воздух, теплопроводность которого очень мала.
* Д. Дьюар (1842—1923) — английскийхимик и физик.

Рассмотрим два сосуда 1 и 2, поддерживаемых соответственно при температурах T 1 и Т 2 (рис. 75) и соединенных между собой трубкой. Если длина свободного пробега молекул гораздо меньше диаметра соединительной трубки (< l > << d), то стационарное состояние газа характеризуется равенством давлений в обоих сосудах (p 1 = р 2). Стационарное же состояние ультраразреженного газа (< l > >> d), находящегося в двух сосудах, соединенных трубкой, возможно лишь в том случае, когда встречные потоки частиц, перемещающихся из одного сосуда в другой, одинаковы, т. е.

где п 1и п 2 — концентрации молекул в обоих сосудах, < v 1> и < v 2> — средние скорости молекул. Учитывая, что n = p /(kT) и 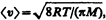 из условия (49.1) получаем
из условия (49.1) получаем
 (49.2)
(49.2)
т. е. в условиях высокого вакуума выравнивания давлении не происходит. Если в откачанный стеклянный баллон (рве. 76) на пружину 1 насадить слюдяной листочек 2, одна сторона которого зачернена, и освещать его, то возникнет разность температур между светлой и зачерненной поверхностями листочка. Из выражения (49.2) следует, что в данном случае разным будет и давление, т. е. молекулы от зачерненной поверхности будут отталкиваться с большей силой, чем от светлой, в результате чего листочек отклонится. Это явление называется радиометрическим эффектом. На радиометрическом эффекте основано действие радиометрического манометра.
8.1. Начертить и объяснить графики изотермического и изобарного процессов в координатах p и V, p и T, T и V.
8.2. В сосуде при температуре t = 20°C и давлении р = 0,2 МПа содержится смесь газов — кислорода массой m 1 =16 г и азота массой m 2 = 21 г. Определить плотность смеси. [2.5 кг/м3]
8.3. Определить наиболее вероятную скорость молекул газа, плотность которого при давлении 40 кПа составляет 0,38 кг/м3. [478 м/с]
8.4. Используя закон о распределении молекул идеального газа по скоростям, найти закон, выражающий распределение молекул по относительным скоростям и (u = v / v B). [ 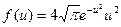 ]
]
8.5. Воспользовавшись законом распределения идеального газа по относительным скоростям (см. задачу 8.4), определить, какая доля молекул кислорода, находящегося при температуре t = 0°C, имеет скорости от 100 до 110 м/с. [0,4]
8.6. На какой высоте плотность воздуха в два раза меньше, чем его плотность на уровне моря? Считать, что температура воздуха везде одинакова и равна 273 К. [5,5 км]
8.7. Определить среднюю продолжительность свободного пробега молекул водорода при температуре 300 К и давлении 5 кПа. Эффективный диаметр молекул принять равным 0,28 нм. [170 нс]
8.8. Коэффициенты диффузии и внутреннего трения при некоторых условиях равны соответственно 1,42×10–4 м2/с и 8,5 мкПа×с. Определить концентрацию молекул воздуха при этих условиях. [1,25×1024 м–3]

Глава 9 Основы термодинамики
§ 50. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
Важной характеристикой термодинамической системы является ее внутренняя энергия U — энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия — однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
В § 1 было введено понятие числа степеней свободы: это число независимых переменных (координат), полностью определяющих положение системы в пространстве. В ряде задач молекулу одноатомного газа (рис. 77, а) рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать (r ® 0, J = mr2 ® 0, T вр =Jw 2/2®0).
В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис. 77, б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i = 5). Трехатомная (рис. 77, я) и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 значения < e 0> в (43.8):

В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/ 2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы

где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:

В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равнасумме кинетических энергий N a молекул:
 (50.1)
(50.1)
Внутренняя энергия для произвольной массы т газа.
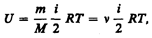
где М — молярная масса, n — количество вещества.
§ 51. Первое начало термодинамики
Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. Внутренняя энергия системы может изменяться в результате различных процессов, например совершения над системой работы или сообщения ей теплоты. Так, вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего его температура повышается, т. е. тем самым изменяется (увеличивается) внутренняя энергия газа. С другой стороны, температуру газа и его внутреннюю энергию можно увеличить за счет сообщения ему некоторого количества теплоты — энергии, переданной системе внешними телами путем теплообмена (процесс обмена внутренними энергиями при контакте тел с разными температурами).
Таким образом, можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте. Энергия механического движения может превращаться в энергию теплового движения, и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии; применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.

Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U 1, получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U 2, совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, а работа — положительной, когда система совершает ее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии D U=U 2– U 1 будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил:

или
 (51.1)
(51.1)
Уравнение (51.1) выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Выражение (51.1) в дифференциальной форме будет иметь вид

или в более корректной форме
 (51.2)
(51.2)
где dU — бесконечно малое изменение внутренней энергии системы, dA — элементарная работа, dQ — бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а dA и dQ таковыми не являются. В дальнейшем будем использовать запись первого начала термодинамики в форме (51.2).
Из формулы (51.1) следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж).
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии D U =0. Тогда, согласно первому началу термодинамики,
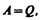
т. е. вечный двигатель первого рода — периодически действующий двигатель, который совершал бы бóльшую работу, чем сообщенная ему извне энергия, — невозможен (одна из формулировок первого начала термодинамики).
§ 52. Работа газа при изменении его объема
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 78). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние d l, то производит над ним работу

где S — площадь поршня, S d l=dV— изменение объема системы. Таким образом,
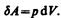 (52.1)
(52.1)
Полную работу А, совершаемую газом при изменении его объема от V 1 до V 2, найдем интегрированием формулы (52.1):
 (52.2)
(52.2)
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Пусть изменение давления газа при его расширении изображается кривой на рис. 79. При увеличении объема на dV совершаемая газом работа равна pdV, т. е. определяется площадью полоски с основанием dV, заштрихованной на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V 1 до объема V 2, определяется площадью, ограниченной осью абсцисс, кривой p = f(V) и прямыми V 1 и V 2.
Графически можно изображать только равновесные процессы — процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
§ 53. Теплоемкость
Удельная теплоемкость вещества — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:

Единила удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг × К)).
Молярная теплоемкость —величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
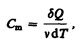 (53.1)
(53.1)
где n= m / М — количество вещества.
Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль × К)).
Удельная теплоемкость с связана с молярной С m, соотношением
 (53.2)
(53.2)
где М — молярная масса вещества.
Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.

Запишем выражение первого начала термодинамики (51.2) для 1 моль газа с учетом формул (52.1) и (53.1):
 (53.3)
(53.3)
Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (см. (52.1)) и сообщаемая газу извне теплота вдет только на увеличение его внутренней энергии:
 (53.4)
(53.4)
т. е. молярная теплоемкость газа при постоянном объеме СV равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К. Согласно формуле (50.1), 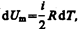 тогда
тогда
 (53.5)
(53.5)
Если газ нагревается при постоянном давлении, то выражение (53.3) можно записать в виде

Учитывая, что 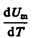 не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от p, ни от V, а определяется лишь температурой Т) и всегда равна СV (см. (53.4)), и дифференцируя уравнение Клапейрона — Менделеева pVm=RT (42.4) по T (p =const), получаем
не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от p, ни от V, а определяется лишь температурой Т) и всегда равна СV (см. (53.4)), и дифференцируя уравнение Клапейрона — Менделеева pVm=RT (42.4) по T (p =const), получаем
 (53.6)
(53.6)
Выражение (53.6) называется уравнением Майера; оно показывает, что Ср всегда больше СV на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, таккак постоянство давления обеспечивается увеличением объема газа. Использовав (53.5), выражение (53.6) можно записать в виде
 (53.7)
(53.7)
При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение Сp к СV :
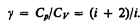 (53.8)
(53.8)
Из формул (53.5) и (53.7) следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение молекулярно-кинетической теории справедливо в довольно широком интервале температур лишь для одноатомных газов.Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы.
По закону равномерного распределения энергии по степеням свободы (см. § 50), для комнатных температур СV = 7 / 2 R. Из качественной экспериментальной зависимости молярной теплоемкости СV водорода (рис. 80) следует, что СV зависит от температуры: при низкой температуре (»50 К) СV = 3 / 2 R, при комнатной — CV = 5 / 2 R (вместо расчетных 7/2 R) и при очень высокой — Сv= 7/2 R. Это можно объяснить, предположив, что при низких температурах наблюдается только поступательное движение молекул, при комнатных — добавляется их вращение, а при высоких — к этим двум видам движения добавляются еще колебания молекул.
Расхождение теории и эксперимента нетрудно объяснить. Дело в том, что при вычислении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул (возможны не любые вращательные и колебательные энергии, а лишь определенный дискретный ряд значений энергий). Если энергия теплового движения недостаточна, например, для возбуждения колебаний, то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень свободы «замораживается» — к ней неприменим закон равнораспределения энергии). Этим объясняется, что теплоемкость моля двухатомного газа — водорода — при комнатной температуре равна 5/2 R вместо 7/2 R. Аналогично можно объяснить уменьшение теплоемкости при низкой температуре («замораживаются» вращательные степени свободы) и увеличение при высокой («возбуждаются» колебательные степени свободы).
§ 54. Применение первого начала термодинамики к изопроцессам
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются изопроцессы, при которых один из основных параметров состояния сохраняется постоянным.
Изохорный процесс (V =const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат (рис. 81), где процесс 1—2 есть изохорное нагревание, а 1 — 3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.

Как уже указывалось в § 53, из первого начала термодинамики (dQ= d U+dA)дляизохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии:

Согласно формуле (53.4),

Тогда для произвольной массы газа получим
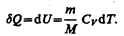 (54.1)
(54.1)

Изобарный процесс (p =const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, параллельной оси V. При изобарном процессе работа газа (см. (52.2)) при увеличения объема от V 1 до V 2 равна
 (54.2)
(54.2)
и определяется площадью заштрихованного прямоугольника (рис. 82). Если использовать уравнение (42.5) Клапейрона — Менделеева для выбранных нами двух состояний, то
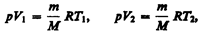
откуда
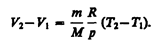
Тогда выражение (54.2) для работы изобарного расширения примет вид
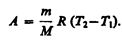 (54.3)
(54.3)
Из этого выражения вытекает физический смысл молярной газовой постоянной R:если T 2 — T 1 =1 К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой т количества теплоты
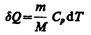
его внутренняя энергия возрастает на величину (согласно формуле (53.4))
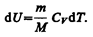
При этом газ совершит работу, определяемую выражением (54.3).
Изотермический процесс (T =const). Как уже указывалось § 41, изотермический процесс описывается законом Бойля—Мариотта:
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 471; Нарушение авторских прав?; Мы поможем в написании вашей работы!