
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Альдегиды и их производные
|
|
|
|
Спирты
Ациклические и карбоциклические лекарственные средства
Органических лекарственных средств.
Алгоритм изучения
I. Общая характеристика класса органических соединений.
1. Определение, классификация, номенклатура.
2. Физические и химические свойства соединений.
II. Биологическая роль класса органических соединений.
III. Фармакопейный анализ лекарственного средства:
1. латинское, международное, русское название;
2. структура лекарственного вещества, химическое название;
3. источники, способы получения;
4. описание препарата, растворимость, физические константы;
5. подлинность: реакции на функциональные группы и специфические качественные реакции;
6. чистота (доброкачественность);
7. количественное определение:
· название метода,
· химические взаимодействия,
· расчет фактора эквивалентности (условной части), эквивалента определяемого вещества, индикация метода, определение титра.
IV. Хранение препарата в зависимости от физико-химических свойств.
V. Применение, форма выпуска.
Спирты - это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами. В общем виде молекулу спирта можно представить как R – ОН.
В зависимости от количества гидроксильных групп в молекуле спирта, молекулярной массы, характера углерода, к которому присоединяется гидроксильная группа, характера углеводорода, лежащего в основе молекулы спирта, спирты имеют некоторые различия в физических и химических свойствах. Спирты подразделяют:
1) в зависимости от количества гидроксильных групп в молекуле на одноатомные (I) и многоатомные (II, III);
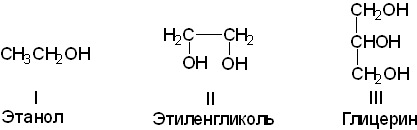
2) по характеру углерода, к которому присоединяется гидроксильная группа на первичные (I), вторичные (II) и третичные (III);
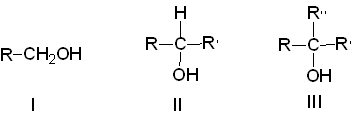
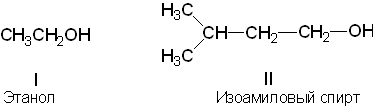
3) по характеру углеводорода на:
а) алифатические - углеводород представлен в виде цепочки неразветвленной (I) или разветвленной (II);
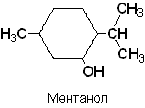
б) циклические - гидроксильная группа замещает атом водорода в циклическом углеводороде.
Во всех приведенных соединениях функциональной группой является спиртовая гидроксильная группа, именно этой группой обусловлены физические, химические и фармакологические свойства спиртов.
Так, например, гидроксильная группа повышает растворимость вещества. Спирты, особенно низшие, растворяются в воде. С увеличением длины углеводородной цепи растворимость уменьшается. Как правило, вторичные спирты более растворимы, чем первичные, а третичные более растворимы, чем вторичные. Это относится и к температуре кипения: температура кипения понижается от первичных спиртов к третичным.
Многоатомные спирты имеют сладкий вкус, это свойство возрастает с увеличением гидроксильных групп в молекуле спирта.
Спирты имеют нейтральную реакцию и реагируют с щелочными металлами с выделением водорода:
2ROH + 2Na → 2RONa + H2↑
Образуют с кислотами сложные эфиры:
| Н+ |
R-OH + R 'COOH → R-COOR ' + H2O
Первичные и вторичные спирты легко окисляются. При окислении первичных спиртов (I) образуются альдегиды, при окислении вторичных (II) - кетоны.
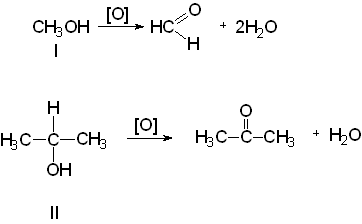
Третичные спирты окисляются с большим трудом.
Фармакопейным препаратом является спирт этиловый.
Спирт этиловый 95 %
Spiritus aethylicus 95%
С2Н5ОН
Этанол
Spiritus Vini 95%
Спирт винный 95% М. м. 46,07
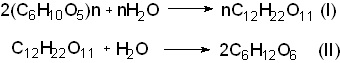
Получение. Спирт этиловый может быть получен из природных соединений и синтетически. В первом случае он получается в результате брожения сахаристых веществ. Полисахариды под влиянием ферментов превращаются в сахар - мальтозу (I), которая в свою очередь расщепляется до глюкозы ( II ):
Конечным продуктом брожения глюкозы является этиловый спирт, или этанол:
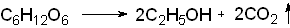
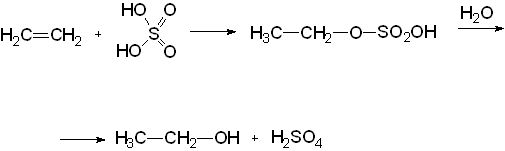
Этиловый спирт может быть получен синтетически из непредельных соединений:
1) из этилена при действии на него серной кислоты. Последняя присоединяется к этилену, образуя серноэтиловый эфир, который при действии воды расщепляется на этанол и серную кислоту;
2) ацетилена по реакции Кучерова. Способ заключается в каталитическом гидрировании уксусного альдегида, который в свою очередь получается из ацетилена.
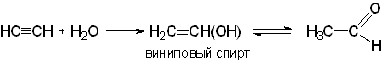
Уксусный альдегид отгоняется и восстанавливается водородом в присутствии катализатора (никель, сульфат ртути и др.), при этом получается этиловый спирт.
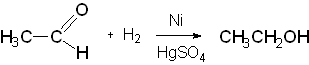
Этиловый спирт, предназначенный для медицинских целей и полученный любым из приведенных методов, подвергается тщательной очистке от возможных примесей путем дробной перегонки (ректификации). При этом удается получить 95-96% этанол. Для получения безводного (абсолютного) этанола используются химические методы связывания воды, например негашеной известью или безводным сульфатом натрия:
CaO + H2O → + Ca(OH)2
Более современным методом обезвоживания этанола является использование этилата алюминия, который поглощает воду, превращаясь в нерастворимый гидроксид алюминия:
Al(OC2H5)3 + 3H2O → Al(OH)3↓ + 3C2H5OH
ГФ описывает следующие препараты этилового спирта: спирт этиловый 95%; 90%; 70%; 40%,
Этиловый спирт - прозрачная жидкость. Он летуч, легко воспламеняется, имеет характерный запах, жгучий вкус; горит синеватым, слабо светящимся пламенем, смешивается во всех отношениях с водой, эфиром, хлороформом, ацетоном и глицерином.
Определение подлинности. Подлинность этилового спирта устанавливается следующими реакциями:
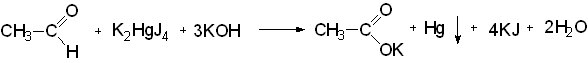
1) образованием йодоформа при взаимодействии с раствором йода в щелочной среде:
CH3CH2OH + 4J2 + 6NaOH → CHJ3↓ + HCOONa + 4NaJ + 5H2O
Реакция чувствительная, но недостаточно специфичная для этилового спирта, ее дают также соединения, имеющие в молекуле этоксильную группу ОС2Н5, ацетогруппу  , например ацетон, некоторые оксикислоты;
, например ацетон, некоторые оксикислоты;
2) образованием сложных эфиров с органическими кислотами. При взаимодействии этилового спирта с ледяной уксусной кислотой в присутствии концентрированной серной кислоты образуется уксусно-этиловый эфир, обладающий своеобразным запахом:
CH3CH2OH + CH3COOH → CH3CH2OCOCH3
3) окислением спирта:
а) дихроматом калия в присутствии серной кислоты с образованием ацетальдегида с характерным запахом свежих яблок.
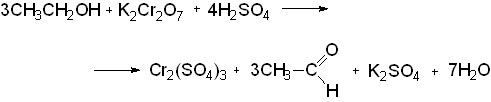
При этом жидкость будет окрашена в зеленый цвет, вследствие образования Cr2(SO4)3;
б) перманганатом калия в присутствии серной кислоты.
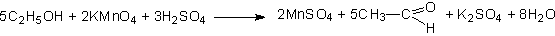
Образующийся ацетальдегид, как и в первом случае, можно определить органолептически, а также химическими реакциями:
· с нитропруссидом натрия Na2[Fe(CN)5NO] в среде пиридина - на фильтровальной бумаге, смоченной этим реактивом возникает синее пятно;
· с реактивом Несслера в щелочной среде образуется черное пятно Hgна фильтровальной бумаге, пропитанной данным реактивом.
Испытание на чистоту.
В качестве примесей в этиловом спирте могут быть: продукты его окисления (ацетальдегид и уксусная кислота); продукты дегидратации (непредельные соединения, обладающие восстановительной способностью); остатки продуктов сырья и полупродуктов синтеза. Например, если этиловый спирт был получен в результате брожения сахаристых веществ, в нем может быть примесь сивушных масел (смесь высших спиртов - бутилового и изоамилового), которые определяют по неприятному запаху.
В гидролизном спирте, полученном из древесных опилок, может быть примесь метилового спирта. Эта примесь недопустима, так как метиловый спирт очень ядовит и в определенной концентрации может привести к тяжелому отравлению, слепоте и смерти. В качестве примеси в этиловом спирте могут быть дубильные вещества, если он хранился в дубовых бочках.
Учитывая возможность наличия в этаноле приведенных примесей, ГФ предъявляет определенные требования к чистоте этилового спирта, применяющегося для медицинских целей. Так, нормируется предел кислотности этилового спирта, предлагается проводить реакции обнаружения альдегидов с аммиачным раствором нитрата серебра, восстанавливающих веществ - с раствором перманганата калия, который не должен обесцвечиваться в течение 20 мин.
Дубильные вещества рекомендуется определять добавлением к пробе этилового спирта небольшого количества раствора аммиака, при этом не должно появляться окрашивания. И обязательно требуется проведение реакции обнаружения примеси метилового спирта. Для этой цели используется общая реакция на спирты - окисление перманганатом калия в кислой среде. В этом случае окисляется как сам этиловый спирт, так и примесь метилового спирта.
При окислении метилового спирта образуется формальдегид:
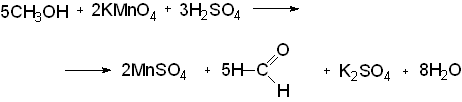
который подтверждается реакцией конденсации с фенолами и, в частности, с фенолокислотой (хромотроповой) с образованием продукта конденсации фиолетового цвета. Ацетальдегид, образующийся при окислении этилового спирта, этой реакции не дает, так как способность к реакции конденсации у него очень мала.
Количественное определение содержания этанола проводится с помощью пикнометра, позволяющего измерить плотность этилового спирта. В зависимости от концентрации этанола величина плотности различна. Чем меньше концентрация этанола, тем величина плотности больше. В ГФ приводятся таблицы зависимости плотности от концентрации этанола (алкоголеметрические таблицы).
Применение. По фармакологическим свойствам спирт этиловый относится к веществам наркотического действия. Воздействуя на кору большого мозга, он вызывает характерное алкогольное возбуждение, в больших дозах - ослабление процессов возбуждения в коре и подавление деятельности дыхательного центра.
При концентрациях 50-70 % спирт обладает хорошими дезинфицирующими свойствами и применяется для дезинфекции рук и хирургических инструментов.
В медицинской практике спирт применяют обычно как наружное антисептическое и раздражающее средство для обтираний и компрессов. Спирт этиловый в различных разведениях применяется для изготовления настоек, экстрактов и ряда лекарственных форм, применяемых наружно. Спирт, кроме того, широко применяется в химической практике как растворитель. Спирт служит основным сырьем для ряда химических производств, из спирта получают уксус, хлороформ, йодоформ, различные эфиры.
Хранение. Хранить следует в хорошо закупоренных стеклянных бутылях в прохладном месте.
| Функциональная группа | 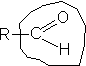
|
Она определяет общие химические свойства веществ, общие реакции идентификации.
Физиологическое действие лекарственных средств, производных альдегидов, главным образом зависит от характера альдегидного радикала.
Формальдегид – антисептическое, глюкоза – общеукрепляющее средство, цитраль (содержит непредельные связи) – снижает артериальное давление. Удлинение радикала приводит к усилению физиологической активности, но вместе с этим возрастает и токсичность.
Введение галогена повышает его наркотическое (снотворное) действие. Так наркотическое действие хлораля более выражено, чем у ацетальдегида.
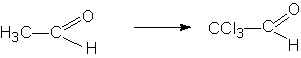
| хлораль |
Токсичность альдегидов снижается за счет образования гидратных форм. Хлоралгидрат применяется в медицине как снотворное средство.
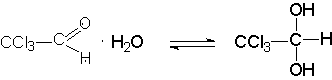
По физическим свойствам альдегиды могут быть газообразными (формальдегид), жидкими (низшие альдегиды), нерастворимые твердые (высшие альдегиды).
Альдегиды хорошо растворяются в спирте, эфире. Низшие альдегиды имеют неприятный, удушливый запах. Альдегиды с большой молекулярной массой – приятный цветочный.
Химические свойства.
Альдегиды весьма реакционноспособные соединения, это обусловлено наличием в их молекуле поляризованной двойной связи.
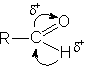
Из химических свойств альдегидов, лежащих в основе их реакционной идентификации, можно отметить следующие:
1. Альдегиды легко окисляются, являясь хорошими восстановителями.
1) Реакция «серебряного зеркала»
К раствору AgNO3 прибавляют несколько капель раствора NH3 и 2 – 3 капли раствора препарата, нагревают на водяной бане, выделяется металлическое серебро в виде зеркала или серого осадка.
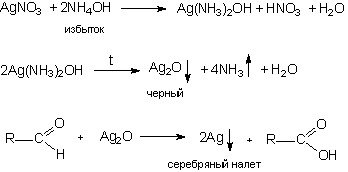
2) Реакция с реактивом Фелинга
К раствору исследуемого альдегида добавляют реактив Фелинга, нагревают, при этом постепенно выпадает осадок Cu2O кирпично-красного цвета.
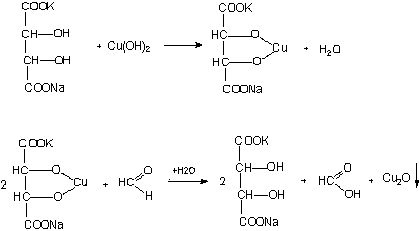
| кирпично-красный |
3) С реактивом Несслера
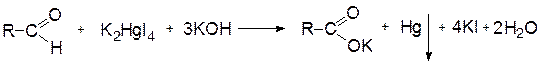
2. Реакции присоединения (продукты таких реакций могут использоваться для идентификации альдегидов, т.к. они имеют определенную температуру плавления).
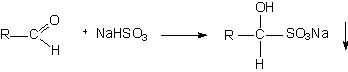
| гидросульфит натрия | кристаллическое вещество определенной температуры плавления |
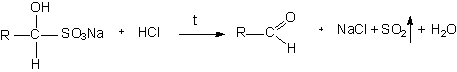
Этой реакцией пользуются и для очистки альдегидов от примесей.
3. Реакции замещения (конденсации) по кислороду альдегидной группы.
1) Конденсация с аминами
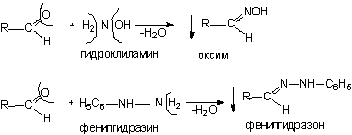
2) Конденсация с фенолами (с салициловой кислотой)
К раствору салициловой кислоты в концентрированной серной кислоте прибавляют раствор препарата и нагревают, появляется красное окрашивание.
Фармакопейными препаратами альдегидов являются:
· Формальдегид (формалин)
· Гексаметилентетрамин, физиологическое действие которого основано на действии HCOH, выделяющегося в солянокислой среде.
(CH2)6N4 + 4HCl + 6H2O → 4NH4Cl + 6HCOH
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 12556; Нарушение авторских прав?; Мы поможем в написании вашей работы!