
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механізм процесів розчинення
|
|
|
|
Біологічна роль розчинності речовин пов’язана зі здатністю їх проходити через біологічні мембрани. У зв’язку з тим, що біохімічні реакції в організмі людини переважно відбуваються у водних розчинах, велике значення має розчинність сполук у воді. Розчинність речовин – це здатність розчинятися у тому чи іншому розчиннику. Вона тим більша, чим сильніша взаємодія між компонентами розчину. Розчинність різних сполук у воді змінюється в широких діапазонах. Так, якщо в 100 г розчиняється більше 10 г речовини, то таку речовину прийнято вважати добре розчинною; якщо розчиняється менше 1 г речовини – малорозчинною; якщо в розчин переходить менше 0,001 г речовини – практично нерозчинною. Розчинність може бути виражена в тих одиницях, що і концентрація.
При розчиненні речовини відбувається два процеси: взаємодія розчинника з частинками розчиненої речовини та руйнування структури розчиненої речовини. Раніше існувало дві теорії розчинів: фізична та хімічна. Згідно першій розчини розглядали як механічні суміші, згідно другої – як нестійкі хімічні сполуки частинок розчиненої речовини та розчинника. Хімічна теорія ґрунтується на тому, що під час розчинення між частинками розчиненої речовини і розчинника утворюються нестійкі комплекси - сольвати (якщо розчинником є вода - гідрати). Сучасна теорія розчинів об’єднує фізичну й хімічну точку зору і розглядає розчинення як фізико-хімічний процес взаємодії між частинками різної полярності. Полярними розчинниками є вода, кислоти, спирти, кетони, тощо. До неполярних розчинників відносять бензен, сірководень, хлороформ, етери, тощо. Доказом того, що процес розчинення – це фізико-хімічний процес, в якому відбуваються як фізичні, так і хімічні процеси, є хімічна взаємодія розчинної речовини з розчинником, що супроводжується тепловими ефектами та зміною забарвлення розчину. Таким чином, у відповідності із сучасними уявленнями, розчинення – це фізико-хімічний процес, в якому має місце як фізична, так і хімічна взаємодія.
Розчинність. На розчинність речовин впливають різні чинники: природа речовини і розчинника та умови розчинення (температура, тиск). Так, речовини молекулярної, але не полярної будови добре розчиняються у неполярних або мало полярних розчинниках, погано – у воді. Наприклад, бензен добре розчинний в етері; жири – в етері, бензені, гексані. Речовини йонної природи і речовини, молекули яких є полярними, добре розчиняються в полярних розчинниках, таких як вода та спирт. Тому справджується твердження алхіміків: «Similia similibus solventur» («подібне розчиняється в подібному»). При розчиненні твердих речовин у воді об’єм системи практично не змінюється, тому тиск не впливає на розчинність таких речовин. На розчинність твердих речовин впливає температура. Якщо до рівноважної системи тверда речовина + розчинник (насичений розчин) застосувати принцип Ле Шательє, то можна зробити висновок, що в тих випадках, коли процес розчинення є ендотермічним (відбувається з виділенням тепла), підвищення температури призводить до збільшення розчинності. Коли розчинення – екзотермічний процес (відбувається з поглинанням теплоти), з підвищенням температури розчинність знижується. Залежність розчинення твердих речовин від температури зручно представляти графічно, у вигляді кривих розчинності (мал.9).
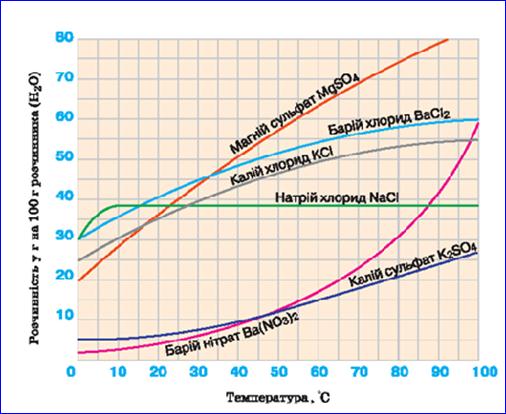 |
Мал.9. Розчинність речовин
З малюнку видно, що для деяких сполук криві розчинності різко зростають (MgSO4, Ba(NO3)2, K2SO4, тощо). Це свідчить, що при підвищенні температури розчинність даних сполук збільшується.
Рідини також можуть розчинятися одна в одній. Деякі з них необмежено розчинні, тобто змішуються в будь-яких пропорціях, наприклад, спирт і вода, інші – взаємно розчиняються до певної межі. Так, якщо перемішати діетиловий етер з водою, то утвориться два шари: верхній – являє собою насичений розчин води в етері, і нижній – насичений розчин етеру у воді. У більшості випадків з підвищенням температури взаємна розчинність рідин збільшується до тих пір, поки не буде досягнута температура, при якій обидві рідини змішуються в будь-яких пропорціях. Збільшення взаємної розчинності обумовлено ендотермічністю процесу розчинення. Температура, при якій обмежена розчинність рідин переходить в необмежену, називають критичною температурою розчинності. Так, при температурі 66,40С фенол обмежено розчинний у воді, а вода – обмежено розчинна у фенолі. Температура 66,40С є критичною температурою розчинності для системи вода-фенол: починаючи з даної температури обидві рідини необмежено розчинні одна в одній. Взаємна розчинність рідин не супроводжується значними змінами об’єму. Тому розчинність рідин в рідинах практично не залежить від тиску.
Якщо в систему, що складається з двох не змішуваних рідин, ввести третю речовину, яка здатна розчинятися в кожній з цих рідин, то розчинена речовина буде розподілятися між обома рідинами пропорційно своїй розчинності в кожній з них. Це положення було сформульовано Нернстом і відомо як закон розподілу Нернста, на основі якого ґрунтується явище екстракції – метод вилучення одного з компонентів розчину за допомогою розчинника, що не змішується з розчином. Екстракцію широко застосовують у фармакологічній практиці для розділення лікарських препаратів та їх метаболітів, а також для виділення речовини із рідин внутрішнього середовища організму. Слід зазначити, що на основі закону розподілу пояснюють проникнення важкорозчинних речовин крізь клітинні мембрани. Так, водонерозчинні неполярні речовини (жирні кислоти, жири, холестерин тощо) проникають у клітину шляхом розчинення у ліпідному шарі мембрани. Вони важко розчиняються у водному середовищі, їх накопичення у ліпідному шарі мембран підлягає закону розподілу.
Розчинення газів у воді представляє екзотермічний процес, тому, з підвищенням температури згідно принципу Ле Шательє розчинність газів зменшується. Відомо, що всі рідини внутрішнього середовища організму є водними розчинами електролітів. Розчинність газів у розчинах електролітів вивчав російський лікар-фізіолог І.Сечєнов. Він довів, що розчинність газів у розчинах електролітів менша, ніж у чистому розчиннику. У відповідності до закону Сеченова неорганічні та органічні сполуки, що містяться в рідинах внутрішнього середовища організму, зокрема в крові, можуть впливати на розчинність газів.
Зміна розчинності газів в крові при зміні тиску може провокувати розвиток важких захворювань. Наприклад, висотна хвороба - це порушення функції органів та систем людини, які спровоковані недостатньою оксигенацією крові і тканин у зв’язку зі зниженням парціального тиску кисню у повітрі. Розвивається при підйомах на висоту більше 4000 м. При високогірних сходженнях, де нестача кисню поєднується з інтенсивною фізичною роботою і дією кліматичних факторів, виникає гірська хвороба.
Перебіг процесів обміну газів людини з оточуючим середовищем описують закони Генрі, Дальтона і Сеченова.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 6682; Нарушение авторских прав?; Мы поможем в написании вашей работы!