
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Практична робота. Дослід № 1. Полімеразна ланцюгова реакція (ПЛР)
|
|
|
|
Дослід № 1. Полімеразна ланцюгова реакція (ПЛР).
ПЛР – це високоспецифічний метод експрес–діагностики, що дозволяє множити певні нуклеотидні послідовності до утворення необмеженого числа копій генів в таких кількостях, які можна виявити методом молекулярної гібридизації за допомогою електрофорезу.
Принцип методу. ПЛР базується на багатократному повторюванні циклів синтезу (ампліфікації) специфічної ділянки ДНК–мішені з дезоксинуклеозидтрифосфатів у присутності термостабільної ДНК–полімерази, відповідного сольового буфера та олігонуклеотидних затравок–праймерів, що визначають кордони ампліфікованої ділянки ДНК-мішені. Для діагностики інфекційного захворювання підбираються системи праймерів, комплементарних специфічним для збудника ділянкам генів, які дозволяють ампліфікувати фрагмент, що має для кожної системи праймерів свою довжину.
Матеріальне забезпечення: 1) Обладнання: прилад ампліфікатор (забезпечує досліджуваним зразкам проходження необхідної кількості циклів, що включають: денатурацію ДНК при температурі 94±2˚С; відпалювання праймерів при температурі від 50 до 65˚С; синтез при температурі 72±2˚С; точність температурного режиму <0,5˚С; швидкість переходу температури >1,5˚С/с; тривалість циклів від 1 с до 4 хв та їх кількість – до 40); автоматичні мікропіпетки на 10 і 20 мкл з точністю до 0,5 мкл; пластикові пробірки на 0,2; 0,5 та 1,5 мл; одноразові наконечники до мікропіпеток; мікроцентрифуга; вортекс; апарат для електрофорезу ДНК в агарозному гелі; джерело постійного електричного струму (V – 50-250В, I – до 50мА); трансілюмінатор з фільтром на 310 нм; ламінарний бокс або бокс для ПЛР; фотоапарат з приставкою для реєстрації результатів ПЛР.
2) Реактиви: Для виділення ДНК з досліджуваних зразків застосовують фенольний або гуанідиновий методи. Використовують такі набори реагентів:
1. Набір для виділення ДНК із біопроб на 100 зразків (зберігають при +4˚С): розчин І (лізуючий) 30мл, розчин ІІ (промивний) 10 мл, розчин ІІІ (промивний) 200 мл, сорбент 1000 мкл, ТЕ-буфер 5мл.
2. Набір для виділення ДНК/РНК із сироватки та плазми крові на 100 зразків (зберігають при +4˚С): денатуруючий розчин – 45 мл, ізопропіловий спирт – 30 мл, промивний розчин – 100 мл, розчин носія – 300 мкл, вода дейонізована – 3 мл, хлороформ – 12 мл.
3. Набір для проведення ПЛР на 110 визначень (зберігати при температурі – 20˚С): реакційна суміш 300 мкл, Тад-полімераза (5 од/мкл) 25 мкл, вода дейонізована –2 мл, масло вазелінове – 2 мл, ДНК контрольна – 50 мкл. Реактив – термостабільну ДНК–полімеразу отримують із спеціального штама Bac. termophilis, сконструйованого методами генної інженерії.
4. Набір для приготування реакційної суміші, до складу якої входять: розчин ДНТФ (дезоксинуклеозидтрифосфати), розчин специфічних праймерів, ПЛР-буфер, барвник. Основним реактивом тут є праймери – специфічні для кожного виду ділянки ДНК; їх отримують хімічним синтезом з відповідною послідовністю для даного виду, що складає 20-30 нуклеотидів. Праймери патентуються і строго зберігаються.
Набори призначені для виявлення in vitro ДНК збудників інфекційних захворювань у біологічних зразках методом ПЛР з праймерами, специфічними до фрагментів геномів цього збудника і можуть бути використані для діагностики і контролю за специфічною терапією певної інфекції, а також бацилоносійства.
Кожний набір розрахований на проведення аналізу 100 клінічних зразків при наявності ДНК збудників 10 зразків позитивного контрольного зразка та 10 зразків негативного (усього 120 визначень).
Зберігання та експлуатація реактивів:
1. Комплекти для виділення ДНК та проведення електрофорезу повинні зберігатися при температурі 4-10˚С.
2. Комплект для проведення ПЛР повинен зберігатися при температурі – 18-25˚С.
Хід роботи:
Принципова схема полімеразної ланцюгової реакції представлена студентам у відеофільмі, який вони передивляються перед виконанням практичної роботи.
Схема проведення ПЛР
1. підготовка клінічних зразків (біоптати тканин, крапля крові, сперма, слиз жіночих статевих органів, осад сечі, волосся людини, зішкреби епітеліальних клітин тощо);
2. виділення ДНК зі зразків (ДНК–матриці генів клітин, вірусів і бактерій більш стійкі, ніж РНК, і тому вони придатні для ПЛР після тривалого часу, навіть після тисячолітньої давності їх існування);
3. проведення циклів полімеразної ланцюгової реакції (реакції ампліфікації) – кожний цикл складається з трьох стадій з різними температурними режимами.
На першій стадії при 94˚С проходить розділення ланцюгів ДНК (денатурація ДНК), на другій при 50–65˚С – приєднання (відпалювання) праймерів до гомологічних послідовностей на ДНК–мішені і на третій при температурі 72˚C – синтез нових ланцюгів ДНК, тобто комплементарна добудова ДНК шляхом подовження праймера у напрямку 5’–3’ з участю ДНК–полімерази в присутності іонів магнію.
Таким чином, у першому циклі ампліфікації синтезуються продукти, які стають матрицями для другого циклу ампліфікації, в результаті якого, власне, і утворюється досліджуваний специфічний фрагмент ДНК – амплікон. Починаючи з третього циклу, амплікони стають матрицями для синтезу нових ланцюгів, тобто у кожному циклі здійснюється подвоєння кількості копій, що дозволяє за 25–40 циклів напрацювати фрагмент ДНК, обмежений парою відібраних праймерів, у кількості, якої достатньо для її детекції за допомогою електрофорезу;
4. розділення продуктів ампліфікації методом горизонтального електрофорезу в агарозному або поліакриламідному гелі; виявляють смуги фрагментів ДНК (ампліконів) за допомогою флуоресцентного барвника (хромофора) – бромистого етидія;
5. перенесення геля на скло трансілюмінатора;
6. аналіз результатів при ввімкнутому трансілюмінаторі, а саме виявлення фрагментів аналізованої ДНК у вигляді оранжево-червоних смуг при УФ–випромінюванні з довжиною хвилі 310 нм; кількість апмпліконів визначають за інтенсивністю їх флуоресценції. Отримані результати можна документувати фотографуванням гелів з використанням оранжевого або інтерференційного (594 нм) світлового фільтру.
Практична робота студентів передбачає вирішення теоретичної задачі з полімеразної ланцюгової реакції. Для запропонованої ділянки ДНК необхідно написати продукти першого, другого і третього циклів ампліфікації (приєднання нуклеотидів відбувається за принципом комплементарності) і написати структуру амплікону.
Приклад задачі
У хворої з попереднім діагнозом на трихомоніаз для ПЛР використали зішкреби епітеліальних клітин уретри. Після виділення ДНК та приєднання праймерів до кожного з ланцюгів ДНК недобудованими залишились дві ділянки (виділені жирним шрифтом):
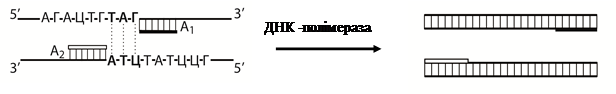 | |||
Дописати згідно схеми ПЛР перший цикл ампліфікації і написати наступні другий та третій цикли, до утворення двох кінцевих продуктів реакції – ампліконів, які стають матрицями подальших полімеразних реакцій.
Зробити висновок.
Клініко - діагностичне значення. У медицині метод ПЛР застосовується для діагностики інфекцій шляхом ідентифікації патогенних бактерій і вірусів у біологічних рідинах та біоптатах тканин людини. З метою діагностики кожної інфекції підбираються специфічні системи праймерів для ПЛР. За допомогою ПЛР одну молекулу ідентифікованої ДНК можна виявити в присутності міліонів інших молекул ДНК. При наявності відповідних наборів можна діагностувати декілька збудників захворювання в одній пробі. Чутливість реакції 97–99 %. ПЛР широко використовують у ранній діагностиці ВІЛ–інфекції, бацилоносійства, вірусних гепатитів тощо, а також для моніторинга і оцінки специфічної терапії певної інфекції, резистентності та чутливості до антибіотиків.
Крім того метод ПЛР використовують для виявлення спадкових захворювань (фенілкетонурія, гемофілія та ін.), проведення „молекулярної дактилоскопії” у судовій практиці, встановлення батьківства, наявності порушень в геномі при онкологічних захворюваннях тощо.
Контроль виконання лабораторної роботи
1. Обґрунтувати механізм дії антибіотиків – інгібіторів ініціації: стрептоміцину, ауринтрикарбоксилової кислоти, рифаміцину, рифампіцину.
2. Обґрунтувати механізм дії антибіотиків – інгібіторів елонгації: аміцетину, хлорамфеніколу, еритроміцину, циклогексиміду, пуроміцину, тетрациклінів.
3. Обґрунтувати механізм дії антибіотиків – інгібіторів термінації: анізоміцину, хлорамфеніколу, еритроміцину, лінкоцину, стрептоміцину.
4. Пояснити механізм дії інтерферонів.
5. Пояснити механізм дії дифтерійного токсину.
6. Пояснити, які методи генної інженерії можуть бути використані в біології та медицині.
7. У сучасних біохімічних дослідженнях для діагностики спадкових захворювань, виявлення присутності в організмі певних вірусів (в тому числі ВІЛ), ідентифікації особини (генна дактилоскопія у судовій медицині) використовується так звана “ДНК–діагностика”. Який метод використовується з цією метою?
А. Електрофорезу
В. Хроматографії
С. Ланцюгової полімеразної реакції
D. Рентгеноструктурного аналізу
E. Електронної мікроскопії
8. Тетрацикліни – це антибіотики широкого спектру дії, які є інгібіторами синтезу білків на 70 S рибосомах прокаріот, не впливаючи при цьому на 80 S рибосоми еукаріот. Рибосоми мітохондрій еукаріот за структурою подібні до рибосом прокаріот (70 S). Використовуючи ці дані, поясніть токсичний ефект тетрациклінів.
9. Що розуміють під поняттям ”клінічний зразок” для ПЛР?
10. На чому грунтується полімеразна ланцюгова реакція? Назвіть склад реакційної суміші для проведення ПЛР.
11. Охарактеризуйте три стадії циклу синтезу (ампліфікації) специфічної ділянки ДНК–мішені.
12. З якою метою при проведенні ПЛР використовують затравку– праймер? На чому ґрунтується підбір системи праймерів для діагностики кожної інфекції?
13. Яке клініко-діагностичне та практичне значення ПЛР як методу експрес-діагностики?
Приклади тестів „Крок – 1”
1. При захворюванні на дифтерію спостерігається інгібування процесу трансляції у клітинах людини за рахунок втрати фактором елонгації еEF-2 властивості здійснювати транслокацію пептидного залишку з А- на П-сайт рибосом. Який фермент є причиною блокування еEF-2?
A. АДФ-рибозилтрансфераза
B. еIF-2-Протеїнкіназа
C. Пептидилтрансфераза
D. Пептидилтранслоказа
E. Гіпоксантингуанінфосфорибозилтрансфераза
2. Для лікування інфекційних бактеріальних захворювань використовують антибіотики (стрептоміцин, неоміцин, канаміцин). Який етап синтезу білків мікробної клітини вони інгібують?
A. Реплікацію
B. Транскрипцію
C. Трансляцію
D. Процесинг
E. Сплайсинг
3. За допомогою якого ферменту здійснюється шлях синтезу різних генів з матричних РНК та ДНК в генній інженерії (цей фермент каталізує процес, відкритий у деяких РНК–вмісних вірусів)?
А. Ревертази
В. Екзонуклеази
С. Ендонуклеази
D. ДНК–лігази
Е. Хелікази
4. Пацієнтові, що проживає на специфічній геохімічній території, встановлено діагноз – ендемічний зоб. Який вид посттрансляційної модифікації тиреоглобуліну порушений в організмі хворого?
А. Фосфорилювання
В. Метилювання
С. Ацетилювання
D. Йодування
Е. Глікозилювання
5. Спадкова інформація зберігається в ДНК, хоч безпосередньо у синтезі білка в клітині вона не бере участі. Який процес забезпечує реалізацію спадкової інформації у поліпептидний ланцюг?
А. Транскрипція
В. Трансляція
С. Транслокація
D. Реплікація
Е. Трансформація
Тема самостійної індивідуальної роботи для студентів
1. Характеристика процесів транскрипції в нормі та при патології. Програмована загибель клітини. Апоптоз та його біохімічні механізми.
2. Генна інженерія. Клонування. Застосування методів генної інженерії у сучасній медицині.
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – С. 300-329.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 361 - 395.
3. Гонський Я.І., Максимчук Т.П. Біохімія людини. – Тернопіль: Укрмедкнига, 2001. – С. 448 – 506.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – К.: Медицина, 2010. – 360 с.
5. Біохімічні показники в нормі і при патології. Довідник / За ред. Склярова О.Я. – К.: Медицина, 2007. – 320 c.
6. Клінічна біохімія. Курс лекцій для студентів вищих навчальних медичних закладів / За ред. проф. Склярова О.Я. – Львів, 2004. – 295 с.
7. Практикум з біологічної хімії / За ред. О.Я. Склярова. – К.: Здоров’я, 2002. – 297 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 469–498, 509–544.
2. Баранов В.С. Генная терапия – медицина ХХІ века // Соросовский образовательный журнал. – 1999. – № 3. – С. 63–68.
3. Жиравецький М.І. Методи детекції нуклеїнових кислот в діагностиці статевих трансмісивних хвороб // Лаб. діагностика. – 2001. – № 1. – С. 28–34.
4. Кінах М.В., Луцик Б.Д., Захарія К.А. Лабораторна діагностика захворювань, які передаються статевим шляхом. – Львів, 2004. – 176 с.
5. Кольман Я., Рем К. Наглядная биохимия. – М.: Мир, 2000. – С. 234–259.
6. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 94 – 126.
Змістовий модуль № 14. Молекулярні механізми дії гормонів на клітини-мішені.
Тема № 5. Дослідження молекулярно-клітинних механізмів дії гормонів білково-пептидної природи на клітини-мішені. Механізми дії гормонів – похідних амінокислот та біогенних амінів.
Мета заняття: Вивчити молекулярні механізми дії гормонів білково-пептидної природи та похідних амінокислот (на прикладі катехоламінів) на клітини-мішені за участю сигнальних молекул-посередників. Засвоїти методи якісного визначення інсуліну, адреналіну в біологічних рідинах.
Актуальність теми: Розуміння біохімічних механізмів впливу гормонів білково-пептидноїприроди на активність внутрішньоклітинних систем дозволяє проаналізувати причини, які лежать в основі розвитку порушень, викликаних розладами у функціонуванні ендокринних залоз, що здійснюють синтез цих гормонів, а також формує у студентів підходи до можливості корекції патологічних станів, що виникають при гіпо- або гіперфункцій відповідних залоз внутрішньої секреції.
Конкретні завдання:
Ø Трактувати біохімічні та фізіологічні функції гормонів та біорегуляторів у системі міжклітинної інтеграції життєдіяльності організму людини.
Ø Аналізувати та пояснювати відповідність структури гормонів білково–пептидної природи, похідних амінокислот виконуваній функції та механізму дії на клітини мішені.
Ø Трактувати молекулярні механізми дії гормонів білково–пептидної природи та похідних амінокислот (на прикладі катехоламінів) на клітини мішені за участю сигнальних молекулярних посередників.
Теоретичні питання
1. Гормони та інші біорегулятори у системі міжклітинної інтеграції функцій організму людини. Визначення, властивості. Класифікація гормонів за хімічною будовою, місцем синтезу.
2. Регуляція гормональної секреції за прямим та зворотнім зв’язком в організмі людини (навести приклади). Фактори, що впливають на секрецію та характер дії гормонів.
3. Мішені гормональної дії; типи реакцій клітин на дію гормонів. Рецептори гормонів: мембранні (іонотропні, метаботропні) та цитозольні рецептори, їх молекулярна організація. Білки – трансдуктори.
4. Мембранний і мембранно-цитозольний механізми дії гормонів (похідних амінокислот, пептидних, білкових) за участю наступних месенджерних систем:
· циклічних нуклеотидів (значення G–білків, цАМФ, цГМФ, серинових, треонінових протеїнкіназ);
· фосфоінозитидної системи (значення Gq, ІФ3, ДАГ, системи Са2+/кальмодулін, серинових, треонінових протеїнкіназ);
· тирозинових протеїнкіназ на прикладі інсулінового рецептора).
5. Гормони гіпоталамусу (ліберини та статини, значення нейрофізинів) і епіфіза (мелатонін). Механізм їх дії.
6. Тропні гормони передньої частки гіпофізу:
· група "гормон росту (соматотропін) - пролактин - хоріонічний соматомамотропін"; патологічні процеси, пов'язані з порушенням функцій СТГ, соматомединів, пролактину;
· група глікопротеїнів - тропних гормонів гіпофіза (тиреотропін, гонадотропіни - ФСГ, ЛГ) Хоріонічний гонадотропін;
· гімейство проопіомеланокортину (ПОМК) – продукти процесингу ПОМК (адренокортикотропін, ліпотропіни, ендорфіни).
7. Гормони задньої частки гіпофіза: вазопресин (антидіуретичний гормон) та окситоцин. Механізм їх дії. Патологія, пов'язана з порушенням продукції АДГ. Використання окситоцину в медичній практиці.
8. Характеристика гормонів підшлункової залози:
· ендокринна функція підшлункової залози (інсулін, глюкагон, соматостатин, панкреатичний поліпептид):
· інсулін – будова, біосинтез та секреція; характеристика інсулінових рецепторів, молекулярні механізми дії (вплив на обмін вуглеводів, ліпідів, амінокислот та білків; рістстимулюючі ефекти інсуліну; фактори росту та онкобілки);
· глюкагон – хімічна природа і біологічна дія гормону;
9. Катехоламіни: адреналін, норадреналін, дофамін. Хімічна природа, реакції синтезу, біологічна дія, рецептори. Їх роль у реалізації стресу.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1038; Нарушение авторских прав?; Мы поможем в написании вашей работы!