
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окклюзия
|
|
|
|
Адсорбция
Иондардың ионды-кристалдық тұнбалармен адсорбциялануы тұнбаның бетіндегі иондардың маңайында электростатикалық өріс болуына негізделген. Осының нәтижесінде кристалдың беткі қабатындағы катиондар өзіне аниондарды тартып қосып алады, ал тұнбаның беткі қабатындағы аниондар ерітіндідегі катиондарды өзіне тартады. Иондардың адсорбциялану қабілеттігі олардың ерітіндідегі концентрациясына және зарядына байланысты. Ерітіндінің концентрациясы мен иондардың заряды неғұрлым жоғары болса, соғұрлым олардың адсорбциялану қабілеттігі артады. Ерітіндідегі зарядтары және концентрациясы бірдей иондардың таңдамалы адсорбциясы Панет-Фаянс-Ган заңдылығына бағынады. Бұл заң бойынша ионды-кристалдық тұнба алдымен оның құрамына кіретін бір ионмен нашар еритін, не нашар ионизацияланатын қосылыс беретін иондарды адсорбциялайды. Сонымен қатар кристалдық тордағы иондардың әсерінен көбірек деформацияланатын иондар жеңіл адсорбцияланады. Мысалы, AgI тұнбасымен күміс ацетаты күміс нитратына қарағанда күштірек адсорбцияланады, себебі CH3COOAg ерігіштігі AgNO3-ке қарағанда төмен.
Адсорбциялану қабілеттігіне адсорбцияланатын иондардың мөлшері де әсер етеді. Тұнбадағы біртектес иондармен мөлшері бірдей иондардың адсорбциялану мүмкіншілігі жоғары. Мысалы, CaSO4 тұнбасы Ra2+ иондарын адсорбцияламайды, ал BaSO4 тұнбасы толық адсорбциялайды десе болады. Ra2+, Ba2+, Ca2+ иондарының иондық радиустарын (1,43; 1,35 және 0,99 Ǻ сәйкес) салыстырса Ca2+ мен Ra2+ иондарының мөлшері жуық мәнмен 1,5 есеге ажырайды. CaSO4 тұнбасының Ra2+ иондарын адсорбцияламау себебі осы айырмашылықта.
Тұнбаның қоспаларды адсорбциялау қабілеттігі оның беткі қабаты үлкейген сайын артады. Сондықтан адсорбцияланған қоспалардың саны тұнба бөлшектерінің мөлшеріне өте байланысты. Аморфты тұнбаларда адсорбция құбылысы ең көп мөлшерде жүреді, ұсақ кристалды тұнбалардың адсорбциялағыш қабілеттігі аморфты тұнбаларға қарағанда кем, қоспаларды ең аз адсорбциялайтын тұнба – кристалды тұнбалар.
Окклюзия құбылысында тұнбаны ластайтын заттар тұнба бөлшектерінің ішінде жүреді. Бұл заттар тұнбаның кристалдық торын құруға қатыспайды. Окклюзияның адсорбциядан айырмашылығы қосарланатұнған қоспалар тұнбаның беткі қабатында емес, оның ішкі құрылысына кіреді. Окклюзия әртүрлі себептерден тууы мүмкін: кристаллизациялану процесінде қоспаларды ұстап қалу, кристаллизациялану процесі жүріп жатқанда адсорбциялау, тұнба мен қосарланатұнатын қоспаның арасында химиялық қосылыс түзілу.
Пайда болатын кристалдар әбден дұрыс кристалдық тор түзбейді. Оларда ерітінділермен толатын ұсақ жарықтар, қуыстар болуы мүмкін. Сонымен қатар ұсақ кристалдар қосылғанда олардың арасында ерітіндінінің қалып қалу мүмкіншілігі бар. Бөгде қоспалардың механикалық жолмен тұнбаларды ластауы кристаллизациялану құбылысы тез жүргенде артады, себебі бұл кезде дұрыс кристалдық тор түзіліп үлгірмейді.
Химиялық анализ жағдайында тұнба ерітіндіге дайын түрінде енгізілмейді, ол тұндырғышты құйғанда ғана пайда болады. Бұл жағдайда алдымен әрмен қарай ептеп өсетін ұсақ дәнді кристалдар пайда болады және олардың беткі қабаты сәйкес заттардың жаңа қабатымен қапталуына байланысты үнемі жаңарып отырады. Бұл үнемі жаңарып тұратын кристалдардың беткі қабаты ерітіндідегі әртүрлі қоспаларды үздіксіз адсорбциялайды. Кристалдар өскенде бұл қоспалар ептеп тұнбаның кристалдық торына кіретін иондармен ығыстырылады. Бірақ мұндай ығысу толық жүрмеуі мүмкін, сондықтан тұнбаның тұну жағдайына байланысты қоспаның аз не көп мөлшері өсіп жатқан тұнбаның ішінде қалады.
Сонымен окклюзия құбылысы жүруінің бір себебі – қоспалардың тұнба қалыптасып жатқанда адсорбциялануы. Еске алатын жағдай – жоғарыда келтірілген иондардың адсорбциялану заңдылығы мұнда да сақталады. Мысалы, CaC2O4.2H2O тұнбасымен K2C2O4 тұзынан гөрі Na2C2O4 тұзы көбірек окклюзияланады, себебі натрий оксалатының калий оксалатына қарағанда ерігіштіші төмен.
Окклюзия процесінде ерітінділерді құйып араластыру ретінін маңызы зор. Мысалы, BaSO4 тұнбасын BaCl2 ерітіндісіне H2SO4 ерітіндісін тамшылап құйып алсақ, тұнба түзілу Ba2+ иондарының артық мөлшері бар ортада жүреді. Сондықтан тұнба Ba2+ катиондарын, оған қарама-қарсы ион ретінде Cl- аниондарын адсорбциялап BaCl2 тұзымен ластанып түседі. Керісінше, BaSO4 тұнбасын H2SO4 ерітіндісіне BaCl2 ерітіндісін тамшылап құйып тұндырсақ BaSO4 кристалдары SO42- аниондарының артық мөлшері бар ортада түзіледі. Кристалдар SO42- аниондарын адсорбциялап теріс зарядталады, қарама-қарсы ион ретінде ерітіндіден катиондарды адсорбциялайды. Сондықтан тұнбаның құрамында H2SO4, не басқа сульфаттардың қоспасы болады. Осыдан мынандай ереже қорытып шығаруға болады: егер тұндыру кезінде ерітіндіде тұнбаның құрамына кіретін аниондар артық мөлшерде жүрсе, онда көбінесе бөгде катиондар окклюзияланады, керісінше, егер тұнба аттас катиондар артық жүрген ерітіндіден түсірілсе, онда көбінесе бөгде аниондар окклюзияланады.
11.5.4.3. Изоморфизм (аралас кристалдардың түзілуі)
Бірлескен кристалды тор түзіп кристаллизацияланатын заттарды изоморфты заттар дейді. Кристаллизациялану нәтижесінде аралас кристалдар пайда болады. Изоморфизм құбылысының негізі – координациялы саны бірдей және радиустары жуық иондардың кристалдық торда бір-бірінің орнын баса алуында. Мысалы, Ra2+ ионының (1,52 Ǻ) радиусы Ba2+ ионының радиусына (1,43 Ǻ) жуық болғандықтан BaSO4 және RaSO4 – изоморфты сульфаттар. Сондықтан BaSO4 тұнбасын құрамында аз мөлшерде Ra2+ иондары бар ерітіндіден тұндырса, бұл иондар Ba2+ иондарымен бірге пайда болған тұнбаның кристалдарын түзуге қатысады. Яғни, радий сульфаты барий сульфатымен изоморфизм құбылысы нәтижесінде қосарлана тұнады. Изоморфизм құбылысының әсерінен BaCl2 және KMnO4 қоспасы бар ерітіндіге аз мөлшерде қышқыл ортаға дейін күкірт қышқылын қоссақ, күлгін түске боялған тұнба алынады. BaSO4-пен қатар KMnO4-тің біраз мөлшері қосарлана түсіп, тұнбаны ластайды. Бұл мысалда әдеттегідей бір ион изоморфты ауыспай, екі ион изоморфты ауысады. Ba2+ мен SO42- иондарының кристалдық тордағы орнын K+ мен MnO4- иондары басады, себебі бұл қос иондардың жалпы мөлшері шамалас.
11.5.4.4. Соңынан тұну
Алғашқыда алынған таза тұнбаны сол ерітіндіде қалдырса, ол басқа заттың баяу соңынан тұнуы нәтижесінде ластануы мүмкін. Мысалы, кальций оксалатын магний иондары бар ерітіндіден тұндырса, алғашқыда таза CaC2O4 тұнбасы түседі. Егер осы тұнбаны ерітіндіде қалдырса оның бетіне бірте-бірте MgC2O4 тұна бастайды. Осы сияқты Cu2+ мен Zn2+ иондары бар қышқыл ерітіндіден күкіртті сутегін жіберсе, алдымен таза қара мыс сульфиді түседі, бұл ортада мырыш сульфиді түзілмеу керек. Бірақ тұнбаны ерітіндіде қалдырса қара тұнбаның беті ақ мырыш сульфидінің тұнбасымен жабылады.
Негізгі тұнба ерітіндіде қалдырылғанда Панет-Фаянс-Ган ережесі бойынша тұнбаның беткі қабатында тұндырғыштың әжептәуір мөлшері адсорбцияланады, сондықтан оның концентрациясы тұнбаның беткі шекарасында артады. Осының нәтижесінде тұнбаның бетінде екінші заттың иондарының көбейтіндісі (ИК) оның ерігіштік көбейтіндісімен (ЕК) артады да, оның тұнбаға түсу жағдайы пайда болады. Соңынан тұну процесін азайту үшін тұнба мен ерітіндінің жанасу уақытын қысқарту керек.
Бақылау сұрақтары мен жаттығулар
1. AgBr тұнбасының ерігіштігі ерітіндіге a) 0,1M KBr, 0,1M KNO3 құйғанда қалай өзгереді?
2. ЕК ұқсас MgF2 және BaCO3 тұнбаларының ерігіштікітері бірдей ме?
3. BaSO4, BaCO3, AgCl, ZnS тұнбаларының қайсысының ерігіштігі ерітіндінің pH-на тәуелді емес? Неге?
4. Қай ерітіндіде барийдің бихроматпен тұнбасы толық тұнады: 1) CH3COOH, 2) HCl 3) CH3COONa?
5. CaCO3 пен CaC2O4 тұнбаларының ЕК ұқсас, бірақ CaCO3 сұйытылған сірке қышқылында жеңіл ериді, ал CaC2O4 ерімейді. Неге?
6. CaCO3-тің моляры ерігіштігі 0,0069 г/л тең. CaCO3-тің ЕК есептеңіздер.
7. EK (PbSO4)=1,6 ∙10-8; EK (PbJ2)=1,1∙10-9. Осы тұнбалардың моль/л және г/л өлшемдері мен есептелген ерігіштіктерін табыңыз. Неге ЕК төмен тұздың ерігіштігі жоғары?
8. Таза сумен салыстырғанда CaC2O4 -тің (ЕК(CaC2O4)=2,3∙10-9) ерігіштігі 0,01М (NH4)2C2O4 ерітіндісінде неше есе азаяды? Есептеуді: а) активтік коэффициентті еске алмай, б) активтік коэффициентті еске алып жүргізіңіздер.
9. 0,001M SrCl2 және 0,0001 М K2SO4 ерітінділерінің бірдей көлемін араластырғанда тұнба түсе ме? EK(SrSO4)= 3,2 ∙ 10-7.
10. Pb(NO3)2 ерітіндісіне а) H2SO4-тің эквивалентті мөлшерімен, б) 0,01 M моль/л H2SO4 артық қалатындай етіп әрекеттестірсе 100 мл ерітіндіде Pb2+ иондарының неше грамы қалады? EK(PbSO4)= 1,6 ∙ 10-8.
11. EK (AgJ) = 8,3∙ 10-17; EK(PbJ2)=7,1∙10-9; EK(BiJ3)=8,1∙10-19. Келтірілген иодидтердің: а) суда, б) 0,1M NaJ ерітіндісінде, в) 0,1M сәйкес катионның ерітіндісіндегі ерігіштігін тауып, оларды ерігіштіктерінің кемуіне сәйкес орналастырыңдар.
12. EK (AgCl) = 1,78∙ 10-10; EK (PbSO4)=1,6∙10-8 . Осы тұнбалардың 0,05M KNO3 ерітіндісіндегі ерігіштігін табыңыз.
13. Ag2CO3 (EK=8,2 ∙ 10-12), Ag3PO4 (ЕК=1,3∙10-20) тұнбаларының pH 3; 6 және 9 сәйкес ерітініділердегі ерігіштігін табыңыз. H2CO3 (Ka4=5×10-7; Ka2=5×10-11); H3PO4 (K1=7×10-3; Ka2=6×10-8; Ka3=4×10-13).
14. ЕК(CaC2O4)=2∙10-9 . Осы тұнбаның ерітіндінің pH 1; 2; 3; 4; 5; 6 тең болғандағы ерігіштігін табыңыз. Алынған мәндерді график түрінде келтіріңіз. (Eмоль/л – pH): H2C2O4 (Ka1=5∙10-2; Ka2=5∙10-5).
15. Cu 2+ және Mn2+ иондарын сульфид түрінде бөлу үшін ерітіндінің ең аз рН-ы неге сәйкес болу керек? ЕК(CuS)=6,3∙10-36; ЕК(MnS)=2,5∙10-10. H2S: Ka1=10-7; Ka2=10-B.
16. AgSCN (EK=1,1∙10-12) тұнбасының 0,1M NH3 ∙H2O ерітіндісіндегі ерігіштігін табыңыз. 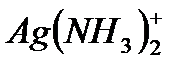 үшін: β1=2×103; β2=7×103.
үшін: β1=2×103; β2=7×103.
17. Мына мәндердің ЕКТ, ЕКК, ЕКШ анықтамасын беріңіздер. Олар бір бірімен қалай байланысқан?
18. “Тұзды эффект” құбылысы деген қандай құбылыс?
19. Неге тұндыруда тұндырғыштың өте көп артық мөлшерін алмаған жөн?
20. Тұнбалардың қышқылдар мен сілтілерде еру себебі неде?
21. Қандай факторлар тұнбаның еруіне көбірек әсер етеді?
22. ЕК мен ε арасындағы байланысты қорытып шығарыңдар. Қандай факторлар осы мәндерге әсер етеді?
23. Кадмий, мыс, темір (ІІІ), мырыш сульфидтерін толық түсіруге сәйкес ерітіндінің рН есептеңдер. ЕК: CdS(2×10-28); CuS(6×10-36); FeS(5×10-18); ZnS(2×10-22).
24. Висмут, темір (ІІ) фосфаттарын толық тұнбаға тұндыру үшін ерітіндінің рН неге сәйкес болу керек? EK(FePO4)=1×10-22; EK(BiPO4)=1×10-25.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2367; Нарушение авторских прав?; Мы поможем в написании вашей работы!