
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сер ететін факторлар 1 страница
|
|
|
|
Тарау
Тұнбаға түсіру және нашар еритін қосылыстардың ерігіштігі
11.1. Тұнба мен ерітіндінің арасындағы тепе – теңдік. Ерігіштік көбейтіндісі
Химиялық реакциялардың негізгі бір аналитикалық әсері –тұнбалар пайда болуы. Тұнбалар, әсіресе түсті болса, көзбен жақсы көрінеді. Тұнба алу реакциялары заттарды бөлуге пайдаланылады. Тұнба түсу процесін сандық жолмен сипаттауға болады: тұнбаның массасын анықтау гравиметриялық анализ, не анықтайтын затты түгел тұнбаға түсіруге кеткен стандартты реактивтің көлемін анықтау – титриметриялық анализ. Осының бәрі тұнба алу реакцияларын заттарды ашуға, анықтауға және бөлуге пайдалануға мүмкіншілік береді.
Тұнба түзілгенде гетерогенді екі фазалы «ерітінді – тұнба» жүйесі пайда болады. Негізгі заңдылықтар кристалдық торы иондардан тұратын нашар еритін электролиттерге қорытып шығарылған. Мұндай жүйедегі тепе теңдікке:
еру
МА ↔ М n+ + A n- (11.1)
тұнба тұну қаныққан ерітінді
әрекеттесуші массалар заңы қолданылады:
 (11.2)
(11.2)
Қатты фазаның активтігін бірге тең деп есептесе:
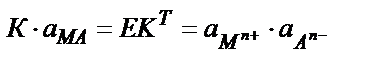
Тұну және еру жылдамдықтары теңескенде нашар еритін электролиттің қаныққан ерітіндісіндегі иондардың концентрацияларының (активтіктерінінің) көбейтіндісі белгілі температура мен қысымда тұрақты мән. Бұл константаны термодинамикалық ерігіштік көбетіндісі деп атайды – ЕКТ.
 (11.3)
(11.3)
(11.3) теңдігі тек артық мөлшердегі ерімеген қатты затпен тепе – теңдікте болған қаныққан ерітіндіге пайдаланылады.


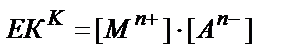 (11.4)
(11.4)
ЕК К – концентрациялы ерігіштік көбейтіндісі Бұл мәнді тек μ→0, fMn+ = fAn- →1 болғанда ғана пайдалануға болады.
Егер тұнба түзілуімен қатар бәсекелес реакциялар жүретін болса шартты ерігіштік көбейтіндісі қорытылады:
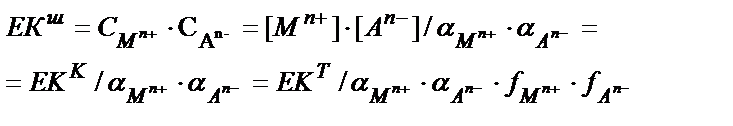 (11.5)
(11.5)
Жалпы жағдайда тұнбаның құрамы МmAn болса
 (11.6)
(11.6)
 ;
;  (11.7)
(11.7)

(11.4), (11.7) теңдіктерінен ерігіштік көбейтіндісі мен заттың молярлы ерігіштігінің (ε) арасындағы байланысты табуға болады:
МА↔Мп++Ап- ; ε = [Mn+]=[An-]
(11.4) теңдігінен:
 (11.8)
(11.8)
Тұнбаның құрамы МmAn болғанда:
МmAn ↔mМп++nАm-
mε nε

 (11.9)
(11.9)
(11.8), (11.9) теңдіктері тұнбаның таза судағы ерігіштігін есептеуге мүмкіншілік береді, яғни табылған ерігіштік тек температура мен қысымға байланысты  = ƒ (to, P). Бұл жағдайда активтік коэффициенттері бірге тең, ал пайда болған иондар қосымша реакцияларға қатыспайды деп есептеледі.
= ƒ (to, P). Бұл жағдайда активтік коэффициенттері бірге тең, ал пайда болған иондар қосымша реакцияларға қатыспайды деп есептеледі.
Мысалы, 25оС –да 500 мл суда неше грамм кальций фосфаты ериді?
EK (Ca3(PO4)2) = 2,0∙10-29
Ca3(PO4)2 ↓↔ 3 Ca2++2PO43-; EK=[ Ca2+]3∙[ PO43-]2
Тұздың еріген ε моль мөлшерінен 3 ε моль Ca2+ және 2 ε моль PO43- пайда болады:
[ Ca2+]=3 ε; [ PO43-]=2 ε; ЕК= (3 ε)3∙(2 ε)2=33∙ ε 3∙22∙ ε2= 33∙22∙ ε5



Тұнбаның ерігіштігі күшті электролиттің ерітіндісінде артады. Бұл құбылыс ерітіндінің иондық күшінің артуына байланысты, ол «тұзды эффект» деп аталады. μ≠0, ƒ<1, (11.3),(11.6) теңдіктерінен:
 ,
, 
Тұнбаның ерігіштігіне ерітіндінің иондық күшіне байланысты иондардың активтік коэффициенті әсер етеді ε=ƒ (t°, P,μ).
Мысалы, 25оС –да 500 мл 0,1М NaNO3 ерітіндісінде неше грамм кальций фосфаты ериді?
Алдымен NaNO3 ерітіндісінің иондық күшін тауып аламыз:
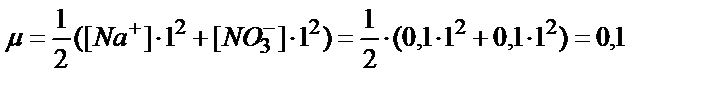
Кестеден осы иондық күшке сәйкес Ca2+ және PO43- иондарының активтік коэффициенттері ƒ(Ca2+)=0,33,ƒ(PO43- )=0,08.

 ,
,
яғни кальций фосфатының 0,1М NaNO3 ерітіндісіндегі ерігіштігі таза судағымен салыстырғанда 10 есе артады.
Егер ерітіндіде бәсекелес бөгде реакциялар жүретін болса (а ≠1, а <1), тұнбаның ерігіштігі бәсекелес реакцияның коэффициенттеріне де тәуелді болады ε =ƒ (t°, P, ƒ, α):
 (11.10)
(11.10)
Тұнбаның ерігіштігіне бәсекелес реакциялардың әсерін төменде қарастырамыз.
11.2. Тұнбаға түсіру жағдайлары
Гетерогенді тұнба түзілу және еру тепе – теңдігінің константасы – ЕК-мәнін пайдаланып тұнба пайда болу процесін реттеуге болады. Тұнба алу үшін ерітіндідегі тұнба түзетін иондардың концентрацияларының көбейтіндісі (ИК) ЕК-нен көп болуы керек ИК>ЕК. Бұл жағдайда ерітінді аса қаныққан болады, тұнба аса қаныққан ерітіндіден қаныққан ерітінді пайда болғанша түседі, яғни ИК= ЕК. Тепе – теңдік орнағаннан кейін тұнбаның пайда болуы тоқталады. Сондықтан тұнбаның толық түсуіне тұнбаға түсіргіштің мөлшері әсер етеді. Тұнбаны толық түсіру үшін тұнбаға түсіргіштің артық мөлшерін қосу керек, бұл жағдайда ИК көбейеді. Тәжірибеде тұнбаға түсіргіштің – 1,5 есе ғана артық мөлшерін қосады, одан артық мөлшері керісінше тұнбаның ерігіштігін арттыруы мүмкін. Оның себептері: 1) «тұзды эффект» құбылысын әсері; 2) бәсекелес комплекс түзу реакциясының жүруі. Келтірілген себептер концентрациялық ерігіштік көбейтіндісінің термодинамикалық ерігіштік көбейткіндісіне қарағанда артуына (ЕКК>ЕКТ), соған байланысты тепе-теңдіктің тұнбаның еру жағына қарай ығысуына әкеп соғады.
Мысалы, барий сульфатының 0,01M Na2SO4 ерітіндісіндегі молярлы ерігіштігін табайық. ЕК(ВаSO4)=[Ba2+]∙[ SO42-]=1,1∙10-10.
ВаSO4↓↔Ba2++ SO42-, ε(ВаSO4)=[Ba2+]
Ерітіндідегі SO42- анионы ВаSO4 тұнбасы пен Na2SO4 -тен пайда болады:
[SO42-]=0,01+[Ba2+]; [SO42-] мәнін ЕК-нің теңідігіне қойсақ: [Ba2+]∙(0,01+[Ba2+])=1,1∙10-10. Барий иондарының дәл концентрациясын табу үшін квадратты теңдікті шешу керек. Тұнбаның нашар еритіндігін еске алып ([Ba2+] ≤ 0,01) теңдіктің жуық шешімін табуға болады:
[SO42-]=0,01; [Ba2+]∙0,01=1,1∙10-10
ε(ВаSO4)=[Ba2+]=1,1∙10-10/10-2=1,1∙10-8 моль/л.
ВаSO4-тің таза судағы ерігіштігін тапсақ:

Аттас (SO42-) ионның қатысында ВаSO4-тің ерігіштігі жуық мәнмен 3000 есе азаяды.
ВаSO4-тің ерігіштігін ерітіндінің иондық күшін еске алып есептесек:


ε(ВаSO4)=[Ba2+]=3,8∙10-8моль/л.
ВаSO4-тің ерігіштігі 3 еседей артады.
Көптеген тұнбалар оның құрамына кіретін ионның біреуімен еритін комплекс түзуі мүмкін. Мысалы, күмістің хлориді хлорид иондарының артық мөлшерінде шамамен AgCl2-, AgCl32- т.б. хлоридті комплекстер түзеді, бұл комплекстер еритін болғандықтан AgCl тұнбасының ерігіштігі артады. (11.10) теңдігінен 
| 0,2 |
| 0,4 |
| 0,6 |
| 0,8 |
| -3 |
| -2 |
| εAgCl, М·10-5 |
| lgCKCL |
| -4 |
| -1 |
| 11.1 – сурет. Күміс хлоридінің калий хлориді ерітіндісіндегі ерігіштігі |
Ерекше назар аударатын заттар амфотерлі гидроксидтер. Мысалы, алюминий, мырыш гидроксидтері алғашқыда тұнбаға түседі, ал гидроксид иондарын артық қосқанда алюминий мен мырыштың гидроксокомплекстері түзіліп тұнба ериді.
Мырышқа сәйкес тепе теңдіктер былай жазылады:
Zn2+ + 2OH-↔ Zn(OH)2↓
Zn(OH)2↓ + 2OH-↔ Zn(OH) 42-
Егер тұнбаға түсіруші ретінде әлсіз қышқылдардың аниондары пайдаланылса (S2-, PO43-, CO2-3 т.б.), тұнбаның толық түсу – түспеуі ерітіндінің рН-на байланысты. Мысалы, сульфидтер мен фосфаттардың әртүрлі рН-та тұнбаға түсуін қарастырайық.
Бөлме температурасында күкіртті сутегінің қаныққан ерітіндісінің концентрацясы 0,1 моль/л шамасында. (5.40) теңдігінен:
 осыдан
осыдан
 (11.11)
(11.11)
С(H2S)=0,1 моль/л, К А,1=8,9∙10-8, КА,2=1,3∙10-13
К А,1∙КА,2= Кж(H2S)=1,1∙10-20
Ерітіндінің рН 1 сәйкес 0,1М CdSO4 және FeSO4 ерітінділерінен қаныққанша күкіртті сутегін жіберсек, кадмий мен темірдің сульфидтері тұнбаға түсе ме?
EK CdS = 7,9∙10-27; EK FeS =5,1∙10-18
Алдымен келтірілген рН-тағы иондардың концентрациясын табамыз. (11.11) теңдігінен:

Енді ИК-ні табамыз да, ЕК-мен салыстырамыз.
[Cd2+]=10-1М; [Fe2+]=10-1М.
ИК=[Cd2+]∙[S2-]=10-1∙10-19=10-20; ИК>>ЕК; 10-20>>7,9∙10-27.
CdS тұнбаға түседі.
ИК=[ Fe 2+]∙[S2-]=10-1∙10-19=10-20; ИК<ЕК; 10-20>>5,1∙10-18.
FeS тұнбаға түспейді.
FeS қандай рН -та тұнбаға толық түседі деген сұрақты қарастырайық. Тұнбаға түсіретін ионның ерітіндіде 10-6 моль/л, не одан аз мөлшері қалса, онда ол тұнбаға толық түсті деп есептеледі.
EK FeS =5,1∙10-18  (11.11)
(11.11)
теңдігінен:

 [Н3О+]=1,4∙10-5 ; pH = 4,90
[Н3О+]=1,4∙10-5 ; pH = 4,90
Темір сульфидін толық тұнбаға түсіру үшін ерітіндінің рН 5, не одан көп болуы керек. Осыдан кез-келген сульфидтерді толық тұнбаға түсіруге қажет ерітіндінің рН есептеп шығаратын жалпы теңдік алуға болады:

Сол сияқты үш негізді фосфор қышқылына (5.44) теңдігінен:


К a ,1=7,6∙10-3; К a ,2=6,2∙10-8, К a ,3=4,4∙10-13
рН 3 болғанда 1М Н3РО4 ерітіндісіндегі РО43- анионының концентрациясын табайық:
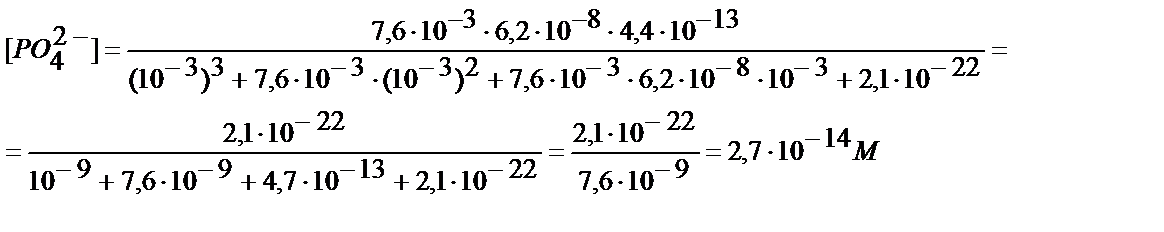
Осы жағдайда FeРО4 тұнбаға түсе ме?
EK (FeРО4)=1,3∙10-22; ЕК=[Fe3+]∙[PO3-4]=1,3∙10-22

10-6 > 4,8∙10-9, яғни, Ғe3+ ионы FePO4 түрінде тұнбаға толық түседі.
11.3. Тұнбаны еріту жағдайлары және ерігіштікке
Тұнбаны еріту үшін ерітіндідегі оның құрамына кіретін иондардың көбейтіндісі (ИК) ерігіштік көбейтіндісінен кем болуы керек ИК<EK. Бұл жағдайда қанықпаған ерітінді пайда болады, тепе-теңдік тұнбаның еру жағына қарай ығысады. Тұнбаның еруі тепе теңдік орнағанша (ИК=ЕК), яғни қаныққан ерітінді пайда болғанша жүреді. Ол үшін тұнбаның қаныққан ерітіндісіндегі иондардың концентрацияларын кеміту қажет. Иондардың концентрацияларын кемітуде бәсекелес реакциялардың маңызы зор. Басекелес реакциялар: 1) тұнбаның иондарын газ бөліп ыдырайтын қосылысқа айналдыру; Мысалы,
СаСО3+2НCl↔Ca2++2Cl-+H2CO3, H2CO3↔H2O+CO2↑.
Карбонаттар күшті қышқылдармен қатар әлсіз сірке қышқылында да ериді:
МСО3↓+2СН3СООН→М2+ + 2СН3СОО- + Н2О +СО2↑.
Карбонаттарды қышқылмен әрекеттестіргенде карбонат иондары әлсіз және тұрақсыз көмір қышқылына айналғандықтан ерітіндідегі СО32- аниондарының концентрациясы азаяды, соның нәтижесінде тепе теңдік солдан оңға қарай ығысады, яғни тұнбаның ерігіштігі артады. Тұнбаны толық еріту үшін қышқылдың жеткілікті мөлшерін қосу керек: 2) тұнба иондарын суда жақсы еритін нашар ионизацияланатын қосылысқа көшіру (қышқыл-негіздік реакциялар); Мысалы, Mg(OH)2↓+2NH4+→ Mg2+ +2NH3∙H2O. Тұнбаның еру қабілеттігі оның ЕК мен пайда болған әлсіз электролиттің ионизациялану константасына байланысты:
І
Mg(OH)2↓ ↔ Mg2+ +2ОН-
+2NH4+
↕ІІ
2NH3∙H2O.
Келтірілген реакцияда екі тепе-теңдік орнайды, реакцияның қорытындысы ерітіндідегі жалпы тепе-теңдіктің мәніне байланысты. Бірінші тепе теңдік Mg(OH)2↓↔ Mg2+ +2ОН- ЕК (Mg(OH)2), ал екінші тепе – теңдік 2ОН-+2NH4+↔2NH3∙H2O (1/ К2 (NH3∙H2O)) константаларымен сипатталады. Жалпы тепе – теңдік әр тепе – теңдік константаларының көбейтіндісіне тең:

Егер жалпы тепе – теңдік константасының мәні бірден көп болса (Кж>1), реакция аяғына дейін жүреді, 1 мен 10-4 аралығында (Кж =1+10-4) болса, реакция аяғына дейін жүру үшін реактивтің артық мөлшерін құю қажет, ал 10-4-тен аз болса (Кж <10-4) реакция жүрмейді. Магний гидроксидінің аммоний тұздарында еру реакциясының тепе – теңдік константасы 1> Кж>10-4 аралығында болғандықтан тұнбаны толық еріту үшін аммоний тұздарының артық мөлшерін қосу қажет. Ерігіштік көбейтіндісі өте аз Fe(OH)3 аммоний тұздарында ерімейді: EK (Fe(OH)3) = 3,7∙10-40:
Fe(OH)3+3NH4+↔ Fe3++3NH3∙H2O

Fe(OH)3 қышқылдарда ериді:
Fe(OH)3+3H+↔ Fe3++3H2O

Егер тұнба әлсіз қышқылдың тұзы болса, мұндай тұздың ерігіштігі ерітіндінің қышқылдығына байланысты өзгереді. Мысалы:
FeS↓+2НCl↔Fe 2++2Cl-+H2S
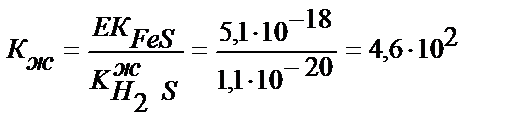 тұнба тұз қышқылында толық ериді.
тұнба тұз қышқылында толық ериді.
Тепе – теңдік константасының мәнінен тұнбаның әртүрлі рН ғы ерігіштігін табуға болады. Ол үшін пайда болған электролиттің ионизациялану константасымен қатар сол электролиттің құрамына кіретін бар бөлшектердің концентрациясын ескеретін бәсекелес реакцияның коэффициенті α мен шартты тепе – теңдік константасын пайдалану қажет.
Сульфид иондарының сутегі иондарымен сатылай байланысатынын еске алсақ:
FeS↓↔Fe 2++ S2-
+H3О+
↕
НS- +H2O+ H3О+® H2S +2H2O
Құрамында сульфид иондары бар бөлшектердің жалпы концентрациясы:
 =[ S2-]+[ НS-]+[ H2S]
=[ S2-]+[ НS-]+[ H2S]
Конкурентті реакцияға S2- ионы қатысқандықтан α( S2-)<1. (5.40) теңдігінен

 ЕК = [Fe2+]∙[ S2-] = [Fe2+]∙C S2- ∙ α S2-
ЕК = [Fe2+]∙[ S2-] = [Fe2+]∙C S2- ∙ α S2-
Тұнбаның молярлы ерігіштігі:
ε = [Fe2+] =  ; ЕК = ε2 ∙
; ЕК = ε2 ∙ 
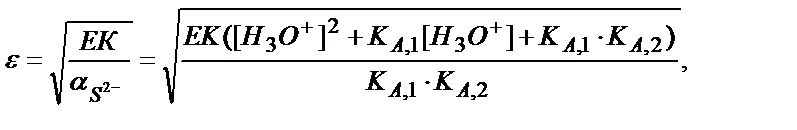
Мысалы, рН 3 және 9-ға тең ерітінділердегі FeS-тің ерігіштігін табайық:
a) pH=3: 

b) pH=9: 
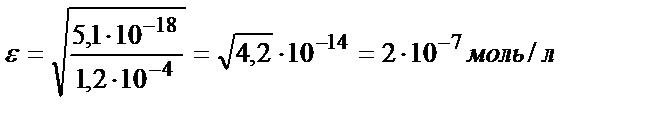
Келтірілген мысалдан ерітіндінің рН артқан сайын FeS-тің ерігіштік қабілеттігінің төмендейтінін көруге болады. Сол сияқты тұнбаның анионы әлсіз үш негізді қышқылдың ионы болса, тұздың ерігіштігі мынадай теңдікпен есептеледі:
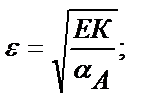

Мысалы, темір (ІІІ) фосфатының рН 2 ерітіндідегі ерігіштігін есептейік:
ЕК(FePO4) =1,3 ∙ 10-22, фосфор қышқылы үшін КА,1=7,6∙10-3; КА,2=6,2∙10-8, КА,3=4,4∙10-13.

ЕК(FePO4)=[Fe3+]CA∙α(PO43-); 
Ал ерітіндінің иондық күшін еске алса
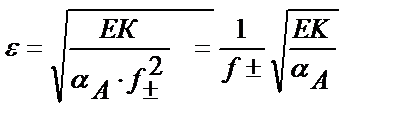
3) Тұнба иондарын тотықтырып, не тотықсыздандырып басқа қосылысқа айналдыру. Көптеген сульфидтер тұз қышқылында ерімейді, себебі олардың ЕК өте аз болғандықтан тұнбаның еруі нәтижесінде пайда болған S2- аниондары сутегі иондарымен байланыспайды. Мысалы, CuS + 2HCl ≠CuCl2 + H2S. Сондықтан оларды еріту үшін тотықтыру реакциясы пайдаланылады:
3CuS↓+8HNO3 → 3Cu (NO3)2 + 3S↓+ 2NO + 4H2O
CuS↓-2e → Cu2 + + So | 3
NO3- + 4H+ + 3e → NO +2H2O | 2
I
CuS↓-2e ↔Cu2 ++ S2-
+
HNO3
↕ II
So ↓ + NO +2H2O
Тұнбаның құрамына кіретін S2- анионы тотығып бос күйіндегі күкіртке айналуы нәтижесінде ІІ тепе-теңдік, соған байланысты І тепе – теңдік те солдан оңға қарай ығысады. Азот қышқылы жеткілікті мөлшерде болғанда сульфид түгел еріп кетеді.
Ерігіштік көбейтіндісі 10 -52 тең HgS азот қышқылында да нашар ериді, оны толық еріту үшін күшті тотықтырғыш – патша сұйығы (3 көлем концентрлі HCl және 1 көлем концентрлі HNO3) пайдаланылады:
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 4499; Нарушение авторских прав?; Мы поможем в написании вашей работы!