
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Иодометрия
|
|
|
|
Бихроматометрия
Бихроматометрия әдісінің негізі – қышқылдық ортада бихромат – анионының тотықсыздану реакциясы:
Сr2О72- + 14Н+ + 6е ® 2Сr3+ + 7Н2О,
fэкв.(Сr2О72-) = 1/6, Е0 (Сr2О72-/2Сr3+) = 1,33В.
К2Сr2О7 тұзының таза кристалды препаратын жеңіл алуға болады. Ол ауада сақтағанда тұрақты, сондықтан бихроматтың стандартты ерітіндісін К2Сr2О7 тұзының дәл нақты мөлшерін алып дайындауға болады.
Темір (II) бихроматпен тұз қышқылды ортада ешқандай шиеленіссіз титрленеді. Реактивтің бір кемшілігі – реакцияның нәтижесінде эквивалентті нүктені анықтауды қиындататын жасыл түске боялған Сr3+ иондарының түзілуі. Бұл әдісте индикатор ретінде дифенилсульфон қышқылы, фенилантронил қышқылы, фосфор қышқылы қатысында дифениламин қолданылады.
Бихроматометрияның ең маңызды тәжірбиелік пайдаланылуы – әртүрлі үлгілердегі темірді анықтау. Алдын ала темір (III) иондарын темір (II) иондарына дейін жоғарыда келтірілген әдістердің бірін пайдаланып тотықсыздандырады.
Тотықтырғыштарды кері титрлеу жолымен анықтайды. Мысалы, болаттардағы хромды Сr2О72— -ионына дейін тотықтырады, содан кейін Мор тұзының Fe(NH4)2(SO4)2×6Н2О титрленген ерітіндісінің артық мөлшерін қосады. Реакцияласпай қалған темір (II) – иондарын бихроматпен титрлейді.
Иодометриялық әдіс I2- нің I- – иондарына дейін тотықсыздану, не I- – иондарының бос иодқа дейін тотығуына байланысты тотығу-тотықсыздану реакцияларына негізделген:
I2 + 2е ® 2 I-, fэкв.(I2) = 1/2,
Иод перманганат пен бихроматқа қарағанда әлсіз тотықтырғыш, ал I- – иондары Сr3+ пен Мn2+ иондарымен салыстырғанда күшті тотықсыздандырғыш. Осыған байланысты I2/2I- тотығу-тотықсыздану жұбын екі жақты пайдалануға болады: 1) тотықсыздандырғыштарды I2-мен титрлеп анықтау; 2) тотықтырғыштарды I- -иондарымен тотықсыздандыру. I- иондарының тотығуы нәтижесінде бөлініп шыққан иодты натрий тиосульфатының ерітіндісімен титрлеу:
I2 + 2S2O32- ® 2 I- + S4O62-
2S2O32- -2e ® S4O62-, fэкв.(Na2S2O3) =1, себебі екі тиосульфат ионы екі электрон жоғалтады.
Сонымен иодометриялық әдісте жұмысшы ерітінділер ретінде иодтың және тиосульфаттың ерітінділері пайдаланылады.
Тиосульфаттың ерітіндісі. Тиосульфаттың химиялық таза кристалды түрін Na2S2O3×5Н2О белгілі жағдайда алуға болады. Бірақ тиосульфаттың судағы ерітіндісі тұрақсыз. Мысалы, ол суда еріген көмір қышқыл газымен әрекеттеседі:
СО2 + Н2О + S2O32- ® НСО3- + НSO3- + S↓
Пайда болған NaНSO3 иодпен әрекеттескенде:
НSO3- + I2 + Н2О ® НSO4- + 2 I- + 2Н+
НSO3- + Н2О -2е ® НSO4- + 2Н+, fэкв.(NaНSO3) =1/2
Тиосульфатқа қарағанда иодтың екі есе артық мөлшері жұмсалады. Осыған байланысты тиосульфаттың иодпен алған титрі артады. Сонымен қатар тиосульфат ерітіндісінің титрі онда ауадан еріген оттегімен әректеттесуі нәтижесінде де өзгереді:
2S2O32- + О2+ ® 2SO42- + 2S↓
Осыған байланысты дайындалған тиосульфат ерітіндісінің титрін оншақты күннен кейін ғана бихромат арқылы анықтайды. Бихроматтың дәл нақты мөлшерін суда ерітеді, оған қышқыл ортада калий иодидінің артық мөлшерін құяды. Реакцияласу нәтижесінде бос иодтың бихроматқа эквивалентті мөлшері бөлінеді де:
Сr2О72- + 6I- + 14Н+ ® 2Сr3+ + 3I2 + 7Н2О
ол әрмен қарай тиосульфатпен титрленеді.
Иодтың ерітіндісі
Иодтың судағы ерігіштігі өте аз (~0,2 г/л не 2×10-3моль/л), сондықтан оның концентрациясы белгілі ерітіндісін кристалды химиялық таза иодтың дәл нақты мөлшерін концентрлі КI ерітіндісінде ерітіп дайындайды. Бұл жағдайда ерітіндіде I3- комплексінің пайда болуына байланысты иодтың судағы ерігіштігі артады.
Иодтың ерітіндісін салқын жерде, қоңыр, тығыз тығынмен жабылған шыны сауытта сақтайды. Уақыт бойынша иод ерітіндісінің титрін тексеріп тұрған жөн, себебі ұзақ сақтағанда суда еріген оттегімен йодид-иондарының тотығуы нәтижесінде:
4I- + O2 + 4Н+ ® 2I2 + 2Н2О
иодтың концентрациясы артады. Иод ерітіндісінің титрін тиосульфат, не арсенит ерітінділерін пайдаланып анықтайды.
Иодометриялық әдісте индикатор ретінде иодпен ашық көк түсті қосылыс беретін крахмал пайдаланылады. Иодометриялық титрлеуді комнаталық температурада және ерітіндінің рН 0-7 аралығында жүргізеді. Сілтілі ортада төмендегі реакциялардың жүруі нәтижесінде титрлеу қиындайды:
I2 + 2ОН- ® IО- + I- + Н2О
4IО- +S2O32- + 2ОН- ® 2SO42- + 4I- + Н2О
Күшті қышқылды ортада иодид – иондарының ауадағы оттегімен тотығу қаупі туады. Иод ерітіндісімен белгілі жағдайда тікелей As(III), Sb(III), Sn(II), сульфит, күкіртті сутегі т.б. тотықсыздандырғыштарды титрлеуге болады. Иодометриялық жолмен мыс (II) иондарын оның тотықтырғыш қасиетін пайдаланып анықтауға болады:
2Cu2+ + 4I-® 2CuI¯ + I2 (10.7)
Бөлініп шыққан иодты тиосульфаттың титрі белгілі ерітіндісімен титрлейді.
Сонымен қатар, осы жолмен тотықтырғыш қасиет көрсетпейтін, бірақ аз еритін хроматтар түзетін катиондарды да (барий, қорғасын т.б.) анықтауға болады. Ол үшін анализдейтін катионды хромат түрінде толық тұнбаға түсіреді, тұнбаны сүзіп, жуып, қышқылда ерітеді. Мысалы:
2ВаСrО4 + 2Н+ ® 2Ва2+ +Сr2О72- + Н2О
Ерітіндідегі бариға эквивалентті мөлшерде бөлініп шыққан бихромат-иондарын иодометриялық әдіспен анықтайды:
Сr2О72- + 6I- + 14Н+ ® 2Сr3+ + 3I2 + 7Н2О
I2 + 2S2O32- ® S4O62- + 2I-
Бұл әдістің бір артықшылығы – йодид иондарымен белгілі стехиометриялық реакцияға қатысатын кез-келген тотықтырғыштарды сутек және металл асқын тотықтары, суда еріген оттегі т.б. анықтауға болады.
Бақылау сұрақтары мен жаттығулар
1. Тотығу-тотықсыздану реакцияларындағы эквиваленттік фактор қалай анықталады?
2. Тотығу-тотықсыздану титрлеуіндегі титрлеу қисығының секірмелі ауданы (эквивалентті бөлімі) қандай факторларға байланысты болады?
3. Перманганатометриялық титрлеу әдісі неге негізделген?
4. Перманганатометрия мен бихроматометрияның артықшылықтары мен кемшіліктері қандай?
5. Не себепті калий перманганатынан оның дәл массасы бойынша титрленген ерітіндісін дайындау мүмкін емес?
6. Екі валентті темірді калий бихроматымен титрлегенде ерітіндіге фосфор қышқылын қосудың себебі неде?
7. Иодометриялық титрлеуді қандай жағдайларда (температура, қышқылдық және т.б.) жүргізеді?
8. Ұзақ сақтау кезінде тиосульфат ерітіндісі титрінің өзгеруінің себебі неде?
9. Төмендегі реакцияларға қатысатын заттардың эквивалентті факторларын табыңдар:
1) 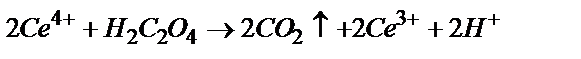
2) 
3) 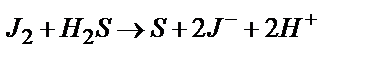
4) 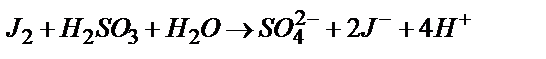
5) 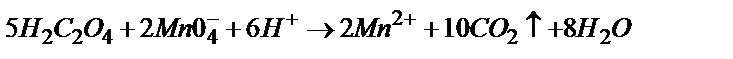
6) 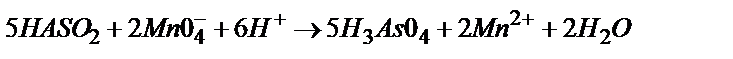
7) 
8) 
10. Перманганатпен тотықтыру реакцияларының қышқыл және сілтілік не бейтарап ортада жүруінде қандай айырмашылық бар? Екі жағдайдағы KMO4-тің эквивалентті факторын табыңдар.
11. Тотығу-тотықсыздану титрлеу қисығының эквивалентті бөлімі алғашқы ерітінділердің концентрациясына, ерітіндінің pH-на, тотықтырғыш пен тотықсыздандырғыштың стандартты потенциалдарының айырымына қалай байланысты?
12. Келтірілген жағдайлардағы: 1) 0,100 М H2C2O4 0,02М KMnO4 (pH 0,0); 2) 0,100 М H2C2O4 0,020 М KBrO3 (pH 0,0) титрлеудің қайсысының эквивалентті бөлімі көп? Неге көп?
13. Fe2+ иондарын KMnO4 ерітіндісімен титрлегенде ерітіндіге 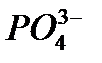 , не
, не  иондарын қосса титрлеу қисығының эквивалентті бөлімі қалай өзгереді?
иондарын қосса титрлеу қисығының эквивалентті бөлімі қалай өзгереді?
14. HNO2 ерітіндісін бірдей қышқылдықта 0,020 М KMnO4 не 0,020 М KClO3 –пен титрлегенде қай жағдайда титрлеудің эквивалентті бөлімі көп?
15. Cu2+/Cu+ және J2/2J- жұптарының тотығу-тотықсыздану стандартты потенциалдарына қайшы  реакция неге солдан оңға қарай жүреді?
реакция неге солдан оңға қарай жүреді?
16. Тотығу-тотықсыздану әдістерінде эквивалентті нүктені қалай анықтайды? Нақтылы мысал келтіріндер.
17. Тотығу-тотықсыздану әдістерінде пайдаланылатын спецификалық индикаторлар мен тотығу-тотықсыздану индикаторларының айырмашылығы неде?
18. Тотығу-тотықсыздану индикаторларын қалай таңдап алады? Нақты мысал келтіріндер.
19. Системаның эквивалентті нүктесінің потенциалы 1,05 В. Эквивалентті нүктені анықтауға қандай индикатор сәйкес?
20. Қандай реакциялар автокатализді реакциялар деп аталады? Мысал келтіріңдер.
21. Неге қымыздық қышқылын перманганатпен титрлегенде оның алғашқы тамшысының бояуы өте баяу жойылады, ал KMnO4 – ті әрмен қарай қосқанда бояуы тез жойылады? KMnO4 – тің алғашқы тамшысы тез түссіздену үшін не жасау керек?
22. Қандай реакциялар индуцирленген деп аталады? Қатарласа тотығу реакциясын қалай түсіндіруге болады?
23. 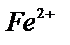 -ні перманганатпен тұзқышқылды ортада титрлегенде
-ні перманганатпен тұзқышқылды ортада титрлегенде 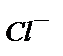 - иондарының тотығуын қалай түсіндіруге болады?
- иондарының тотығуын қалай түсіндіруге болады?
24. Титрлеуге пайдаланатын заттарды алдын-ала тотықсздандыру жолдары? Пайдаланатын тотықсыздандырғыштар қандай шарттарға жауап берулері керек?
25. Мына титрлеулердің титрлеу қисығын салып, индикаторын таңдап алыңыздар:
1) 0,100 М FeSO4 0,100 М Ce(SO4)2;
2) 0,100 М FeSO4 0,05 М NH4VO3 (pH 0,0);
3) 0,100 М FeSO4 0,020 М KBrO3 (pH 1,0);
4) 0,50 М FeSO4 0,010 М K2Cr2O7 (pH 1,0);
5) 0,050 М HNO2 0,020 М KClO3 (pH 0,0);
6) 0,030 М S8Cl3 0,050 М KBrO3 (pH 0,0);
7) 0,100 М K4[Fe(CN)6] 0,020 М KMnO4 (pH 1,0).
26. Төмендегі қоспалардың ерітінділеріндегі потенциалды есептеңдер, керекті жағдайда ерітіндінің pH 0,0 деп алыңдар:
1) 50,00 мл 0,100 М TiCl3+25,00 мл 0,200 М SnCl2;
2) 25,00 мл 0,050 N KNO2+20,00 мл 0,050 М KMnO4;
3) 20,00 мл 0,020 N J2+22,00 мл 0,020 М Na2S2O3;
4) 20,00 мл 0,020 N KJO3+20,00 мл 0,020 М SnCl2.
27. Бір молярлы H2C2O4 және KMnO4 ерітнділерінің эквивалентінің молярлы концентрациясын есептеңдер.
28. а) 500,0 мл 0,050 N; б) 500,0 мл 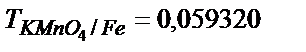 г/мл перманганаттың ерітінділерін дайындауға сәйкес KMnO4 массасын табыңдар.
г/мл перманганаттың ерітінділерін дайындауға сәйкес KMnO4 массасын табыңдар.
29. 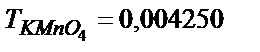 ерітіндісін алу үшін 500,0 мл
ерітіндісін алу үшін 500,0 мл  ерітіндісіне 0,500 М (1/5) KMnO4 – тің қандай көлемін құю керек?
ерітіндісіне 0,500 М (1/5) KMnO4 – тің қандай көлемін құю керек?
30. 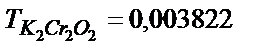 ерітіндісін алу үшін 500,0 мл 0,100 М (1/6) K2Cr2O7 ерітіндісін қандай көлемге дейін сұйылту керек?
ерітіндісін алу үшін 500,0 мл 0,100 М (1/6) K2Cr2O7 ерітіндісін қандай көлемге дейін сұйылту керек?
31. а) 500,0 мл 0,020 М; б) 200,0 мл 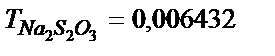 г/мл тиосульфаттың ерітіндісін дайындау үшін
г/мл тиосульфаттың ерітіндісін дайындау үшін 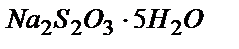 тұзының қандай массасын алу керек?
тұзының қандай массасын алу керек?
32. Күкірт қышқылды ортада 20,00 мл FeSO4 ерітіндісін титрлеуге 22,50 мл 0,100 М (1/6) K2Cr2O7 жұмсалды. Дәл 0,050 М темір сульфаты ерітіндісін дайындау үшін 200,0 мл FeSO4 ерітіндісіне қанша су құю керек?
33. Құрамында 1,09% марганці бар 0,2548 г. болатты ерітіп, марганецті  – ке дейін тотықтырды. Пайда болған
– ке дейін тотықтырды. Пайда болған  ионын титрлеуге 18,50 мл
ионын титрлеуге 18,50 мл 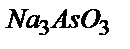 ерітіндісі жұмсалды.
ерітіндісі жұмсалды. 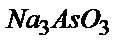 ерітіндісінің эквивалентінің молярлы концентрациясын және оның марганец арқылы титрін есептеңдер.
ерітіндісінің эквивалентінің молярлы концентрациясын және оның марганец арқылы титрін есептеңдер.
34. Сәйкестік өңдеуден кейін темір(II) – ні титрлеуге 20,00 мл 0,100 М KMnO4 ерітіндісін жұмсау үшін құрамында 60,0% Fe2O3 бар руданың қандай массасын алу керек?
35. Қышқыл ортадағы Kl ерітіндісіне 20,00 мл 0,110 N KMnO4 ерітіндісі құйылды, бөлініп шыққан иод 25,90 мл Na2S2O3 ерітіндісімен титрленді. Na2S2O3 ерітіндісінің эквивалентінің молярлы концентрациясын есептеңдер.
36. 0,5600 г техникалық натрий сульфитінен 200,0 мл ерітінді дайындалды. Осы ерітіндінің 20,00 мл титрлеуге 16,20 мл иод жұмсалды  . Үлгідегі Na2SO3 – тің массалық үлесін (%) табыңдар.
. Үлгідегі Na2SO3 – тің массалық үлесін (%) табыңдар.
37. 0,1000 г. темір оксиді ерітіліп, темір Fe2+ – ке дейін тотықсыздандырылды, оны титрлеуге 12,61 мл 0,099 М (1/6) K2Cr2O7 ерітіндісі жұмсалады. Анализдеген заттың құрамында темірдің қай оксиді FeO, Fe2O3, Fe3O3 болғаны?
38. 0,1510 г. техникалық KClO3 еріген ерітіндіге 100,00 мл. 0,098 М (1/2) Na2C2O4 ерітіндісі құйылды, оның артық мөлшері 22,60 мл 0,114 М (1/5) KMnO4 – пен титрленді. Үлгідегі KClO3 – тің массалық үлесін (%) есептеңдер.
39. Пиролюзиттің массасы 0,4000 г. үлгісі құрамында 0,6000 г. H2C2O4×2H2O бар күкірт қышқылымен өңделді, қымыздық қышқылының артық мөлшерін титрлеуге 23,26 мл 0,113 М (1/5) KMnO4 жұмсылды. Үлгідегі MnO2 – нің массалық үлесін (%) есептеңдер.
40. Құрамында 65,00% MnO2 бар үлгіні 50,00 мл 0,100 М (1/2) H2C2O4 ерітіндісіменәрекеттестіргеннен кейін артық қалған қымыздық қышқылын 25,00 мл KMnO4 ерітіндісімен титрлеу үшін үлгінің қанша массасы қажет? 1,00 мл KMnO4 1,05 мл H2C2O4 – пен әрекеттеседі.
41. Болаттың 1,2430 г. ерітілгеннен кейін хром  – қа дейін тотықтырылды. Ерітіндіге 35,00 мл Мор тұзы құйылды,
– қа дейін тотықтырылды. Ерітіндіге 35,00 мл Мор тұзы құйылды, 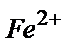 - тің артық мөлшері 16,12 мл KMnO4 ерітіндісімен титрленді.
- тің артық мөлшері 16,12 мл KMnO4 ерітіндісімен титрленді. 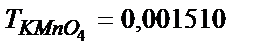 20,00 мл Мор тұзы 42.10 мл KMnO4 –пен әрекеттеседі. Болаттағы хромның массалық үлесін (%) есептеңдер.
20,00 мл Мор тұзы 42.10 мл KMnO4 –пен әрекеттеседі. Болаттағы хромның массалық үлесін (%) есептеңдер.
42. Құрамында мыс бар 0,6215 г. руда ерітілді (Сu2+). Осы ерітіндіге Kl қосылды, бөлініп шыққан иодты титрлеуге 18,23 мл натрий тиосульфаты жұмсалды 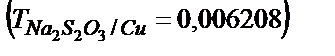 . Рудадағы мыстың массалық үлесін есептеңдер.
. Рудадағы мыстың массалық үлесін есептеңдер.
43. Құрамында қорғасын бар ерітіндіден қорғасын PвCrO4 түрінде тұнбаға түсірілді. Тұнба сүзіліп, жуылып, қышқылда ерітілді және оған артық мөлшерде Kl қосылды. Бөлініп шыққан иодты титрлеуге 21,50 мл 0,101 M Na2S2O3 ерітіндісі жұмсалды. Алғашқы ерітіндіде неше грамм қорғасын болған?
44. Күкірт қышқыл ортасында (pH 0,0) V(III) ерітіндісін бихроматпен титрлеудің индикаторлық қатесін табыңдар: а) ферроин тұсінің ауысу аралығы 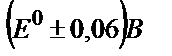 ; б) дифениламин түсінің ауысу аралығы
; б) дифениламин түсінің ауысу аралығы 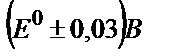 .
.
45. FeSO4 ерітіндісін 2M H2SO4 ортасында KMnO4 ерітіндісімен титрлеудің индикаторлық қатесін есептеңдер: а) ферроин түсінің ауысу аралығы 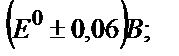 б) дифениламин түсінің ауысу аралығы
б) дифениламин түсінің ауысу аралығы 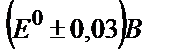 .
.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 4489; Нарушение авторских прав?; Мы поможем в написании вашей работы!