
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тест тапсырмалары 1 страница. Тотығу – тотықсыздану Реакциялары
|
|
|
|
Тарау
Тотығу – тотықсыздану Реакциялары
9.1. Тотығу-тотықсыздану тепе-теңдігі
Әрекеттесетін заттардың біреуінен екіншісіне электрондардың ауысуы нәтижесінде тотығу дәрежелері өзгеріп жүретін реакцияларды тотығу – тотықсыздану, не редокс реакциялар дейді. Электрондарды қосып алатын бөлшектер тотықтырғыштар деп аталады, өздері тотықсызданады. Электрондарды беріп жіберетін бөлшектер тотықсыздандырғыштар деп аталады, өздері тотығады.
Тотығу – тотықсыздану реакцияларында тотықсыздандырғыштар берген электрондар мен тотықтырғыштар қосып алған электрондардың саны тең болу керек.
Тотығу – тотықсыздану реакциясын жартылай тотығу және жартылай тотықсыздану реакцияларына бөлуге болады. Мысалы:
2 Fe 3+ + Sn 2+ ↔2 Fe 2+ + Sn4+ (9.1)
Бұл реакцияның жартылай тотығу реакциясы
Sn 2+ – 2е → Sn4+, не Sn 2+ → Sn4+ + 2е (9.2)
жартылай тотықсыздану реакциясы
Fe 3+ + е → Fe 2+ /*2 2 Fe 3+ + 2е → 2 Fe 2+ (9.3)
Жартылай реакцияға кіретін заттар тотығу – тотықсыздану жұбын түзеді (Sn4+/ Sn 2+, Fe 3+/ Fe 2+ ). Бұл жұптың бір компоненті тотыққан түрі (Sn4+, Fe 3+ ), екінші компоненті тотықсызданған түрі (Sn 2+ , Fe 2+ ) болып табылады.
Тотығу және тотықсыздану реакциялары қатар жүреді, Sn 2+ жоғалтқан электрондарды Fe 3+ қосып алады.
Егер реакцияға құрамында оттегі бар күрделі бөлшектер қатысса атомдардың санын теңестіру үшін жартылай реакцияға сутегі иондары, гидроксил иондары не судың молекулалары кіруі мүмкін. Мысалы,
Fe 2+ + MnO4- →Fe3+ +Mn 2+
Тотықтырғыш МnO4- реакцияның нәтижесінде оның тотықсызданған түрі Mn 2+ -ке айналады. МnO4- → Mn 2+ . Теңдіктің екі жағындағы атомдардың санын теңестіру үшін жартылай реакцияның оң жағына төрт су молекуласы жазылады, осыған байланысты теңдіктің сол жағына сегіз сутегі иондары жазылады:
МnO4- + 8Н+ → Mn 2+ + 4Н2О
Осы жүйенің тотығу – тотықсыздану жұбы МnO4-, 8Н+/Mn2+. Зарядтардың санын теңестіру үшін тепе теңдіктің сол жағына бес электрон қосылады:
МnO4- + 8Н+ +5е → Mn 2+ + 4Н2О (9.4)
Екінші жартылай реакция
Fe 2+ -1e →Fe3+ не Fe 2+ →Fe3++ 1e (9.5)
Қосып алатын электрондар мен берілетін электрондардың санын теңестіру үшін (9.5) реакция беске көбейтіледі:
5Fe 2+ -5e → 5 Fe3+
(9.4) және (9.5) реакцияларын қорытып жазғанда:
| МnO4- + 8Н+ +5е → Mn 2+ + 4Н2О Fe 2+ -1e →Fe3+ | |
| МnO4- + 8Н+ +5 Fe 2+ → Mn2+ + 4Н2О + 5Fe3+ |
Тотығу – тотықсыздану жұбына бейтарап атомдар да кіруі мүмкін. Мысалы:
Cu2+ + Zn0 →Cu0 +Zn2+
Жартылай реакциялар
Cu2+ + 2е →Cu0
Zn0 -2е → Zn2+ не Zn0 →Zn2+ + 2е
Тотығу-тотықсыздану жұптары Cu2+/ Cu0, Zn2+/ Zn0.
Тотығу-тотықсыздану жартылай реакцияларының бір ерекшелігі- электрондардың ауысуы және жалпы тотығу-тотықсыздану реакциялары тотықтырғыш пен тотықсыздандырғышты бір бірінен бөлгенде де жүреді, тек электрондар ауысатын өткізгіш және екі жүйенің арасында иондар ауысатын мүмкіншілік болу керек. Ол үшін екі ерітіндіні тұзды көпіршемен жалғастырады. Тұзды көпірше – электролитпен толтырылған иілген шыны түтікше.
9.1-суретте көрсетілген екі жартылай тотығу-тотықсыздану жұбынан тұратын жүйені гальваникалық элемент деп атайды. Гальваникалық элементте химиялық энергия электр энергиясына айналады. Бұл гальваникалық элементті сызба түрінде былай жазуға болады (+) Cu / Cu2+//Zn2+/Zn (-).
|
+ -
Cu 2 Zn
Cu2++2e |
| V |
| Cu2+ SO42- |
| SO42- Zn2+ |
9.1 – сурет. Гальваникалық элемент.
1-жартылай элементтер. 2-тұзды көпірше. 3-вольтметр.
Сызбада екі жартылай элемент бір бірімен екі тік сызықпен бөлінген, жартылай элементтің тотыққан және тотықсызданған түрі бір тік сызықпен бөлінген. Вольтметр гальваникалық элементтің электр қозғағыш күшін (ЭҚК) көрсетеді. ЭҚК = (Е1 - Е2), Е1– тотықтырғыш потенциалы, Е2– тотықсыздандырғыштың потенциалы. 9.1-суретте келтірілген гальваникалық элементте электрод ролін тотығу-тотықсыздану жұбының (Cu2+/ Cu0, Zn2+/ Zn0) біреуі атқарады: Cu және Zn. Егер электрод ретінде инертті металл платина пластинасын алса, электрондар ауысуы осы металдың бетінде жүреді:
Pt / Fe 3+ (Fe2+) // (Sn4+)Sn2+ / Pt
Fe3+ + 1e → Fe 2+ Sn2+ -2е → Sn4+
Sn2+ иондарының тотығуы нәтижесінде бөлінген электрондар платина пластинкасының бетінен өткізгіш арқылы екінші платина электродына ауысады да, оның беткі қабатында Fe 3+ иондары тотықсызданады. Бағытталған тотығу-тотықсыздану реакциясы, яғни электрондардың ауысуы тепе-теңдік орнағанша жүреді:
2Fe3+ + Sn2+ ↔2 Fe 2+ + Sn4+
Жалпы реакцияның теңдігі және тепе-теңдік жағдайы процестің қай жолмен жүргеніне байланысты емес.
Әр қосылыстың тотығу не тотықсыздану қабілеттігі бірдей емес. Олардың тотығу, тотықсыздану қабілеттігін көрсететін шама – вольтпен өлшенетін тотығу-тотықсыздану потенциалы (электродты потенциал). Жеке жартылай реакцияның потенциалын анықтайтын әдіс жоқ, себебі бар өлшеуіш құрылғылар тек потенциалдар айырымын анықтайды. Сондықтан екі электродтың, яғни екі жартылай реакциялардың потенциалдар айырымы өлшенеді. Ол үшін жеке жартылай реакцияның не жартылай элементтің потенциалын екінші стандартты электродпен салыстырып анықтайды. Сөйтіп әртүрлі тотығу-тотықсыздану жүйелерінің тотығу, тотықсыздану қабілеттілігінің салыстырмалы сипаттамасы алынады.
Негізгі салыстырмалы электрод ретінде стандартты сутек электродын пайдаланады. Бұл газ түріндегі сутегін жақсы адсорбциялайтын, ұсақ дисперстенген платинамен қапталған платина пластинкасы. І атм қысымда газ түріндегі сутегімен қаныққан электрод сутегі иондарының белсенділігі (активтігі) бірге тең ерітіндіге батырылады. Сутегі стандартты электродының потенциалы 0,000 В деп алынады. Платина электрохимиялық реакцияға қатыспайды, тек электрондарды тасымалдауға қатысады. Сутегі электродының жартылай реакциясы Н2(газ)↔2Н+ + 2е, тотығу-тотықсыздану жұбы 2Н+/Н2 . Екінші жартылай электродтың табиғатына байланысты сутегі электроды не катод, не анод рөлін атқарады. Анод болса, электродта жүретін реакция Н2↔ 2Н+ +2е, катод болса 2Н+ +2е → Н2, яғни Н2↔ 2Н+ +2е қайтымды реакция.
Мысалы:
(-) Zn /ZnSO4 (1M) // H2SO4 (1M), H2(газ) / Pt (+)
анод катод
Өз бетімен жүретін реакция
Zn+2H+ ↔ Zn2+ + H2,
мырыш анод рөлін атқарады, яғни гальваникалық элементтің теріс полюсі Zn – 2е ↔ Zn2+ (анодты реакция). Электрондар сыртқы өткізгішпен мырыштан гальваникалық элементтің оң полюсіне (стандартты сутек электродына) бағытталады: 2Н++2е→Н2 (катодты реакция). Сондықтан мырыш электродының потенциалының таңбасы (ЭҚК=Е(2Н+/Н2)-Е(Zn/Zn2+)=(0,00- 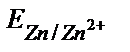 ) теріс
) теріс
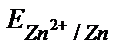 = – 0,76 B.
= – 0,76 B.
(-) Pt/H2 (газ), H2SO4 (1M) // CuSO4 (1M) / Cu (+)
анод катод
Келтірілген гальваникалық элементтегі жартылай реакциялар
Cu 2+ +2e → Cu0 (катодты реакция)
Н2 – 2e → 2Н+ (анодты реакция)
Мыс электродының потенциалы оң мән, себебі ол гальваникалық элементтің катоды. Электрондар сыртқы өткізгішпен сутегінен мысқа бағытталған
(ЭҚК= Е(Cu2+/ Cu0) – Е(2Н+/Н2) = E(Cu2+/ Cu0) – 0,00); 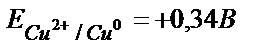 .
.
Өз бетімен жүретін реакция
Cu 2+ + Н2 ↔ 2Н++Cu0
(-) Pt /H2 (газ) H2SO4 (1M) // FeCl3, FeCl2 (C (Fe3+) = C (Fe 2+) / Pt (+)
анод катод
Жартылай реакциялар
Н2 – 2e → 2Н+
2Fe3+ + 2e → 2Fe 2+
Е (Fe3+/Fe 2+) = +0,77В. Өз бетімен жүретін реакция:
Fe3++Н2 Fe 2+ + 2Н+ .
Тотығу – тотықсыздану жұбының потенциалы тек осы жұпқа кіретін тотықтырғыштың және тотықсыздандырғыштың табиғатына ғана тәуелді емес, олардың концентрациясына да тәуелді. Тепе – теңдік потенциалдарының заттардың табиғатына (Ео арқылы есепке алынады), олардың концентрациясына және температураға тәуелділігі Нернст теңдігімен өрнектеледі:
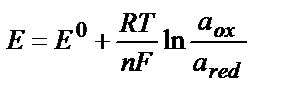 (9.6)
(9.6)
Е – тотығу – тотықсыздану жұбының реалды (тепе – теңдік) потенциалы, В;
Ео – стандартты тотығу – тотықсыздану потенциалы, В.
R – әмбебап газды тұрақтылық, 8,314 Дж/К ∙ моль тең;
F – Фарадей саны, 96500 Кл тең;
n –тотығу-тотықсыздану жартылай реакциясына қатысатын электрондар саны;
αox, αred – заттың тотыққан және тотықсызданған түрлерінің активік концентрациялары.
Тотығу – тотықсыздану реакциясына қатысатын бар компоненттердің активтігі бірге тең болғандағы жартылай реакцияның тотығу-тотықсыздану потенциялы стандартты потенциал деп аталады:
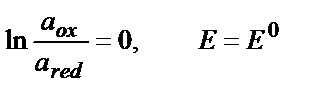 (9.7)
(9.7)
Кейбір тотығу-тотықсыздану жүйелерінің стандартты потенциалдары 4.1 кестесінде келтірілген. Тұрақты F пен R-дің сандық мәндерін қойып, натуралды логарифмді ондық логарифмге ауыстырса (ln=2,3 lg), онда 25 0C-та (9.6) теңдігі былай жазылады:
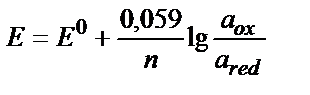 (9.8)
(9.8)
Егер тотықтырғыш – тотықсыздандырғыш жұбының біреуі қатты не газ түрінде жүрсе, Нернст теңдігіне тек сұйық фазада (ерітіндіде) жүрген түрінің активтігі кіреді. Мысалы Zn2+/ Zn0 , 2Н+/Н2 жұптары үшін:
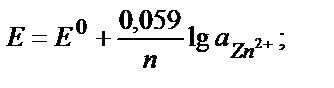
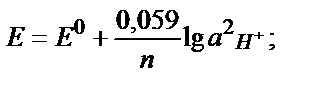
Сұйытылған ерітінділерде активтікті тепе-теңдік концентрациясымен ауыстыруға болады:
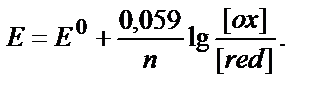
9.1 – кесте.
Кейбір тотығу – тотықсыздану жүйелерінің стандартты потенциалдары
| Тотығу – тотықсыздану жұбы | Жартылай реакция | Ео, В. |
| Na+/Na Mg 2+ / Mg Al3+ / Al | Na – ē = Na+ Mg2+ +2 ē =Mg Al3+ +3e = Al | -2,71 -2,37 -1,66 |
| Тотығу – тотықсыздану жұбы | Жартылай реакция | Ео, В. |
| Cr2+/ Cr Zn2+ / Zn Fe 2+/Fe Cr3+/Cr2+; Pt Cd2+/ Cd Ni2+/Ni Pb2+/Pb 2H+/H2; Pt Sn4+/Sn2+; Pt Cu2+/Cu+; Pt S4O62-/2S2O32-; Pt Cu2+/Cu Fe(CN)63-/Fe(CN)64-; Pt Cu+/Cu J2/2J-; Pt AsO43-/AsO33-; Pt Fe3+/Fe2+; Pt Hg2+/2Hg Ag+/Ag NO3-/NO2-, Pt 2Hg2+/Hg22+; Pt Br2/2Br-; Pt Cr2O72-/2Cr3+; Pt Cl2/2Cl-; Pt BrO3-/Br-; Pt MnO4-/Mn2+; Pt Ce4+/Ce3+; Pt MnO4-/MnO2; Pt H2O2/H2O; Pt | Cr2+ + 2 ē =Cr Zn2+ +2 ē = Zn Fe2+ + 2 ē = Fe Cr3+ + ē =Cr2+ Cd2+ + 2 ē = Cd Ni2++2 ē = Ni Pb2++2 ē = Pb 2H++2 ē = H2 Sn4++2 ē =Sn2+ Cu2++ ē = Cu+ S4O62-+2 ē =2S2O32- Cu2++2 ē =Cu Fe(CN)63-+ ē =Fe(CN)64- Cu++ ē =Cu J2+2 ē = 2J- AsO43-+2H++2 ē =AsO33-+H2O Fe3++ ē =Fe2+ Hg2++2 ē =2Hg Ag++ ē =Ag NO3-+2H++NO2-+H2O 2Hg2++2 ē =Hg22+ Br2+2 ē =2Br- Cr2O72+14H++6 ē =2Cr3++7H2O Cl2+2 ē =2Cl- BrO3-6H++6 ē =Br-+3H2O MnO4-+8H++5 ē =Mn2++4H2O Ce4++ ē =Ce3+ MnO4-+4H++3 ē =MnO2+2H2O H2O2+2H++2 ē =2H2O | -0,86 -0,76 -0,44 -0,41 -0,40 -0,25 -0,12 -0,00 +0,15 +0,15 +0,15 +0,34 +0,36 +0,52 +0,53 +0,58 +0,77 +0,789 +0,799 +0,835 +0,92 +1,06 +1,33 +1,36 +1,42 +1,51 +1,61 +1,69 +1,77 |
9.2.Тотығу – тотықсыздану реакцияларының бағытын анықтау
Тотығу – тотықсыздану реакцияларының бағытын стандартты тотығу – тотықсыздану потенциалдарын салыстырып анықтайды. Реакцияның қаншалықты толық жүргенін білу үшін тотығу – тотықсыздану реакциясының тепе – теңдік константасын табу қажет. Мысалы, 2Fe3+ + Sn2+ ↔2 Fe 2+ + Sn4+ реакциясының тепе теңдік константасы:
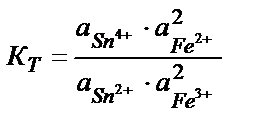
Жүйеде тепе – теңдік орнағанда реакцияға қатысатын тотығу – тотықсыздану жұптарының потенциалдары теңеседі:
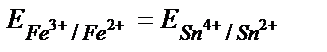
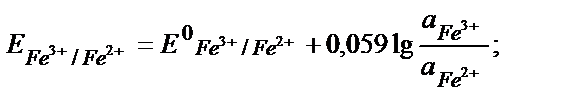
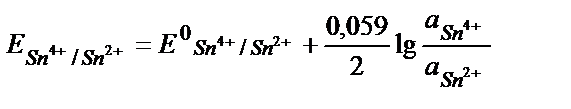
Еске алатын бір жағдай, жартылай реакцияның теңдігінде жалпы реакцияға қатысатын заттардың моль мөлшерін жазу керек:
Fe3+ + е ↔ Fe 2+ /2 2 Fe3+ +2е ↔ 2 Fe 2+, онда:
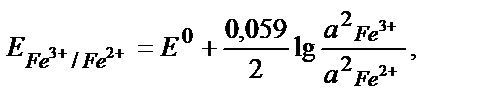 осыдан:
осыдан:
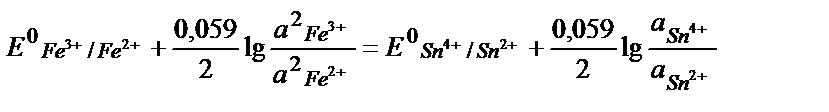
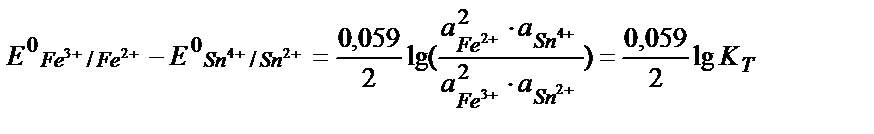
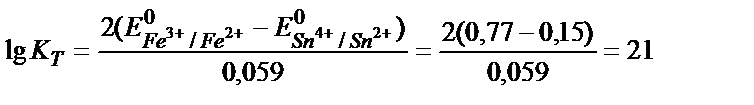 ;
; 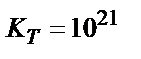
Жалпы түрінде
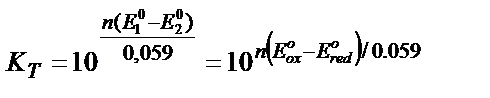
Тағы бір мысал:
MnO4- +5Fe2+ +8H+ ↔ Mn 2+ + 5Fe3+ + 4H2O реакцияның тепе – теңдік константасының мәнін табу:
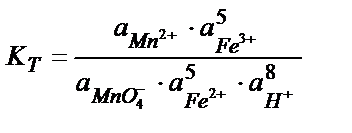
Жартылай реакциялар мен оларға сәйкес стандартты потенциалдар:
MnO4- +8H++5e ↔ Mn2+ + 4H2O 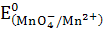 = +1, 51 В
= +1, 51 В
5Fe2+ +5е ↔ 5Fe3+ 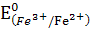 = +0,77 В
= +0,77 В
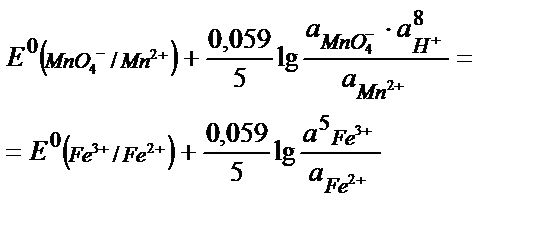
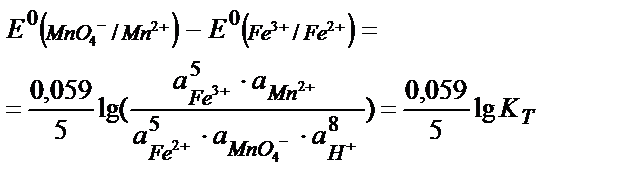
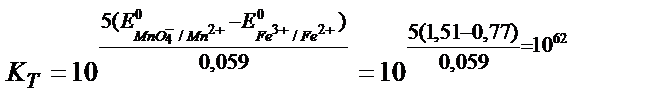
Аяғына дейін жүретін реакцияның тепе теңдік константасы 108 тең, не одан көп болу керек, яғни:
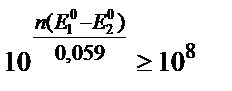
Бұл шарт n=1 үшін (E10 – E 20) ≈ 0,4B, n=2 үшін (E10 – E 20) ≈ 0,2B болғанда сақталады.
Сонымен, тотығу – тотықсыздану реакцияларының бағыты және олардың аяғына дейін жүру-жүрмеуі реакцияға қатысатын жүйелердің тотығу-тотықсыздану потенциалдарының айырымымен анықталады. Потенциалдардың айырымы неғұрлым көп болса, соғұрлым реакция аяғына дейін толық жүреді.
9.3. Тотығу – тотықсыздану потенциалына әртүрлі факторлардың әсері
9.3.1.Ерітіндінің иондық күшінің әсері
Ерітіндінің иондық күшінің өзгеруі иондардың активтік коэффициенттерін өзгертеді. Әдетте заттың тотыққан түрінің заряды тотықсызданған түрінің зарядынан басқаша болатындықтан олардың активтік коэффициенттері әртүрлі дәрежеде өзгереді. Ерітіндінің иондық күшінің әсерін реалды стандартты потенциалды пайдаланып ескеру ыңғайлы. Мысалы,
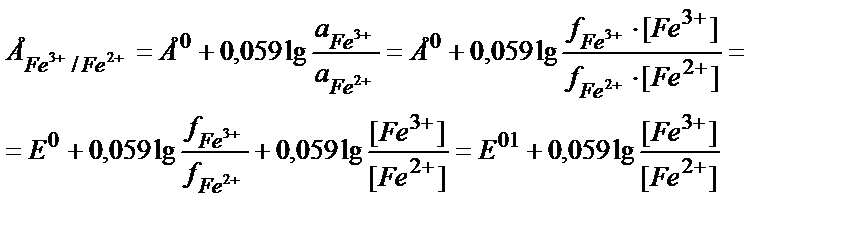
Е01 – реалды жағдайдағы активтік коэффициентерді еске алатын стандартты потенциал:
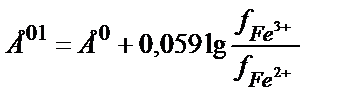 ; Жалпы түрде:
; Жалпы түрде: 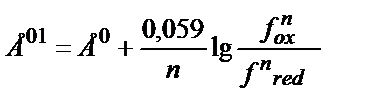
Ерітіндінің иондық күші (J) тұрақты болғанда Е01 мәні де тұрақты болады.
9.3.2. Ерітінді рН-ның әсері
Көптеген судағы ерітіндіде жүретін тотығу-тотықсыздану реакцияларына сутегі (гидроксоний) иондары қатысады. Бұл жүйелердің потенциалы ерітіндінің рН-на тәуелді. Мысалы:
MnO4- +5Fe2+ +8H+ ↔ Mn 2+ + 5Fe3+ + 4H2O
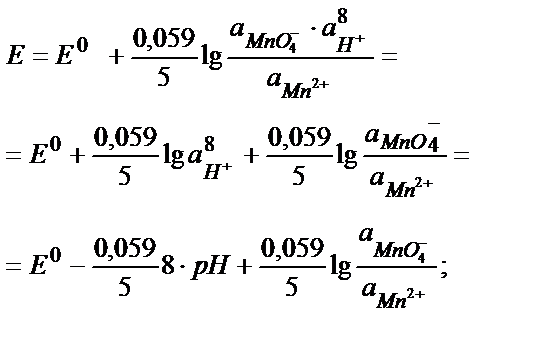
Мына екі жүйенің стандартты потенциалын салыстырғанда өзара реакция жүрмеу керек:
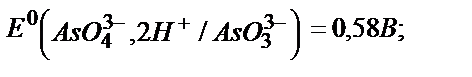
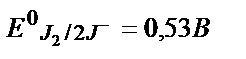
Бірақ бірінші жүйенің АsO43-+2H++2e↔АsO33-+H2O потенциалы ерітіндінің рН-на тәуелді болғандықтан
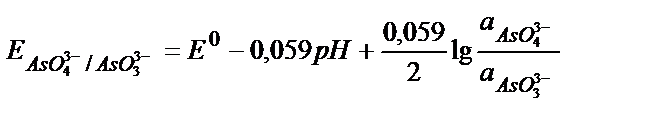
eкі молярлы тұз қышқылы (рН=-0,3) ортасында:
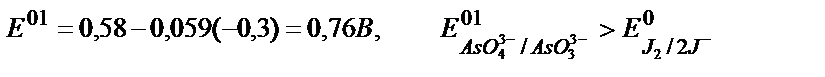
Сондықтан мынадай реакция жүреді:
2J- + AsO43- +2H+ ↔ AsO33- +J2 +H2O (9.8)
Ал бикарбонатты ортада (рН=9):
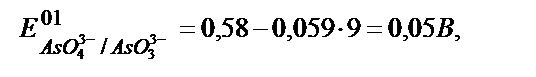
керісінше 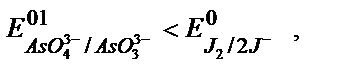 яғни бос күйіндегі иод тотықтырғыш, қасиет көрсетіп, (9.8) реакция кері бағытта жүреді:
яғни бос күйіндегі иод тотықтырғыш, қасиет көрсетіп, (9.8) реакция кері бағытта жүреді:
AsO33- +J2 +H2O ↔ AsO43- +2J- + 2H+
Ерітіндінің рН ның өзгеруі жүйенің потенциалын өзгертіп қана қоймай, реакцияның нәтижесінде басқа заттар түзілуіне себеп болады. Мысалы, күшті қышқыл ортада MnO4- иондары Mn 2+ иондарына дейін тотықсызданады, бейтарап не әлсіз сілтілік ортада тотықсыздану нәтижесінде MnO2 пайда болады, сілтілік ортада MnO42- иондары түзіледі:
MnO4- +8H++5 ē ↔ Mn 2+ + 4H2O; Е0 = +1,51 В (рН<< 7)
MnO4- +4H++3 ē ↔ MnО2 + 2H2O; Е0 = +1,69 В (рН ≈ 7)
MnO4- +2H2O +3 ē ↔ MnО2+ 4ОH-; Е0 = +0,59 В (рН >7)
MnO4-+ 4ОH- + ē ↔ MnО42- + 2H2O+O2; Е0 = +0,58 В (рН>>7)
не
Cr2O72-+14H++6 ē =2Cr3++7H2O; Е0 = +1,33 В (рН << 7)
CrO42-+2 H2O +3 ē =CrО2- +4ОH-; Е0 = -0,13 В (рН >> 7)
Сонымен реакцияның ортасы тотығу-тотықсыздану реакциясының жүруіне өте үлкен әсер етеді. Ерітіндінің рН-ын қадағалап реакцияның жылдамдығын және бағытын да өзгертуге болады.
9.3.3. Kомплексті қосылыс түзілуінің әсері
Тотығу-тотықсыздану потенциалына тотығу – тотықсыздану жұбына кіретін бір, не екі компоненттің бәсекелес комплекстүзу реакциясына қатысуы өте үлкен әсер етеді. Себебі жүйедегі комплекс түзетін компоненттің активтігі азаяды.
Мысалы, аммиакті ортада Ag+/Ag жұбын қарастырайық. Жартылай тотығу – тотықсыздану реакциясы Ag++e→Ag, электродты потенциалдың теңдігі:
Е=Е0+0,059 lg aAg+ =Е0 + 0,059 lg fAg+ + 0,059 lg [Ag+]
Күміс иондарының аммиакті ортада комплекс түзетінін еске алсақ:
Ag++NH3↔Ag(NH3)+ β1=103, 32
Ag++2NH3↔[Ag(NH3)2]+ β·β1,2 =107, 24
CAg+= [Ag+] + [Ag(NH3)+]+ [Ag(NH3)2+]=
= [Ag+] + β1 ∙[Ag+]∙[NH3]+ β1,2 ∙[Ag+]∙[NH3]2
CAg+ /[Ag+] =1+ β1 ∙ [NH3]+ β·β1,2 ∙[NH3]2= 1/α Ag+
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 3950; Нарушение авторских прав?; Мы поможем в написании вашей работы!