
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перманганатометрия 2 страница
|
|
|
|
Е =Е0+0,058 lg*(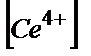 /
/  ) (10.6)
) (10.6)
Бұл жұптың тотықсызданған түрінің (Cе3+) концентрациясы өзгермей, ал тотыққан түрінің (Cе4+) концентрациясы титранттың көлемі артқан сайын өседі. Ерітіндіге титранттың 26,0 мл құйдық дейік:
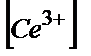 =25,00·0,100;
=25,00·0,100;
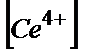 =CСе4+·VСе4+-CҒе2+·VҒе2+=(26,00·0,10-25,00·0,10)=1,00·0,100=0,100 М.
=CСе4+·VСе4+-CҒе2+·VҒе2+=(26,00·0,10-25,00·0,10)=1,00·0,100=0,100 М.
Табылған мәндерді (10.6) теңдікке қойсақ:
Е=1,44+0,058lg(1,00·0,100/25,00·0,100)=1,44+0,058lg(1,00/25,00)=1,36 В.
Тотығу-тотықсыздану титрлеу қисығының бір ерекшелігі – эквивалентті бөлік көп жағдайда ерітіндінің сұйытылуына байланысты емес. Нернст теңдеуіне заттың тотыққан және тотықсызданған түрлерінің концентрацияларының қатынасы кіреді.
10.2. – кесте
25,00 мл 0,100М FeSO4 ерітіндісін 0.100М Ce(SO4)2 ерітіндісімен титрлеу нәтижелері. Е0(Ғе3+/Ғе2+)=0,77В, Е0(Се4+/Се3+)=1,44В
| Титранттың көлемі, V мл | 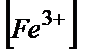 / / 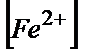
|  / / 
| Е,В |
| 1,00 | 4*10-2 | --- | 0,69 |
| 20,00 | 4*00 | --- | 0,80 |
| 24,00 | 2,4*10 | --- | 0,85 |
| 24,90 | 2,49*102 | --- | 0,91 |
| 24,99 | 2,50*103 | --- | 0,97 |
| 25,00 | --- | --- | 1,10 |
| 25,01 | --- | 4,0*10-4 | 1,24 |
| 25,10 | --- | 4,0*10-3 | 1,30 |
| 26,00 | --- | 3,84*10-2 | 1,36 |
| 30,00 | --- | 1066*101 | 1,41 |
10.1 – суретте келтірілген титрлеу қисығы индикаторды дұрыс таңдап алуға мүмкіндік береді. 10.2 кесте мен 10.1 суреттен қисықтың эквивалентті бөлімі 0,97В 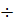 1,24В аралығында жатыр, сондықтан индикатор ретінде фенилантронил
1,24В аралығында жатыр, сондықтан индикатор ретінде фенилантронил  және 2,3-дифениламин-карбон (Ет0=+1,12 В) қышқылдарын алуға болады, ал дифениламин
және 2,3-дифениламин-карбон (Ет0=+1,12 В) қышқылдарын алуға болады, ал дифениламин  титрлеуге жарамайды.
титрлеуге жарамайды.

10.1 – сурет. 25,00 мл 0,100 М FeSO4 ерітіндісін 0.100 М Ce(SO4)2 ерітіндісімен титрлеу қисығы.
Кей жағдайда комплекстүзетін реактивті пайдаланып титрлеу қисығының эквивалентті бөлімін қажетті жаққа ығыстыруға болады. Мысалы Ғе2+ерітіндісін Cr2O  ерітіндісімен титрлегенде дифениламинді индикатор ретінде пайдалануға болмайды, себебі дифениламин өзінің түсін эквивалентті бөлімге (0,95
ерітіндісімен титрлегенде дифениламинді индикатор ретінде пайдалануға болмайды, себебі дифениламин өзінің түсін эквивалентті бөлімге (0,95 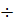 1,30В) кірмейтін потенциалда өзгертеді. Егер ерітіндіге Ғе3+ ионымен тұрақты комплекс беретін фосфор қышқылын қосса (H3
1,30В) кірмейтін потенциалда өзгертеді. Егер ерітіндіге Ғе3+ ионымен тұрақты комплекс беретін фосфор қышқылын қосса (H3 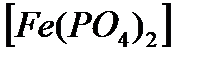 ) Fe3+/Fe2+ жұбының потенциалы 0,53В-қа дейін төмендейді. Осыған сәйкес титрлеу қисығының эквивалентті бөлімі кеңейеді де (0,68-1,33В аралығына дейін), дифениламиннің түсін өзгерту потенциалы (0,76В) қисықтың эквивалентті бөліміне кіреді. Сондықтан Ғе2+-ті бихроматпен фосфор қышқылы қатысында титрлесе индикатор ретінде дифениламин алынады.
) Fe3+/Fe2+ жұбының потенциалы 0,53В-қа дейін төмендейді. Осыған сәйкес титрлеу қисығының эквивалентті бөлімі кеңейеді де (0,68-1,33В аралығына дейін), дифениламиннің түсін өзгерту потенциалы (0,76В) қисықтың эквивалентті бөліміне кіреді. Сондықтан Ғе2+-ті бихроматпен фосфор қышқылы қатысында титрлесе индикатор ретінде дифениламин алынады.
10.4. Тотығу-тотықсыздану титрлеуіндегі индикаторлық қателер
Тотығу-тотықсыздану титрлеуіндегі индикаторлық қателер титрленудің соңғы нүктесі (т.с.н.) мен эквивалентті нүктенің (э.н.) сәйкес келмеуіне байланысты. Титрлеудің соңғы нүктесіндегі потенциал тотығу-тотықсыздану индикаторының потенциалына тең деп алынады. Индикаторлы қатені есептеу үшін реакцияласатын тотығу-тотықсыздану жүйелерінің стандартты потенциалдарын, (Eox/Red) эквивалентті нүктедегі потенциалды (ЕЭ.Н) және тотығу-тотықсыздану индикаторының түсін өзгерту аралығына сәйкес потенциалдарды (E  ) білу керек. Реакцияласатын жүйелердің потенциалдарын пайдаланып ЕЭ.Н мәнін есептейді. Индикатордың потенциалын (Е
) білу керек. Реакцияласатын жүйелердің потенциалдарын пайдаланып ЕЭ.Н мәнін есептейді. Индикатордың потенциалын (Е  ) анықтамалық кестелерден табады. ЕЭ.Н мен E
) анықтамалық кестелерден табады. ЕЭ.Н мен E  мәндерін салыстырып қатенің таңбасын және т.с.н. есептеуге қажетті тотығу-тотықсыздану жұбын анықтайды. Содан кейін заттың тотыққан және тотықсызданған түрінің қоспасын 100 0/0 деп алып, артық титрленген, не титрленбей қалған заттың процентік мөлшерін табады. Индикаторлық қате (0,1-0,2)0/0-тен аспаса, не
мәндерін салыстырып қатенің таңбасын және т.с.н. есептеуге қажетті тотығу-тотықсыздану жұбын анықтайды. Содан кейін заттың тотыққан және тотықсызданған түрінің қоспасын 100 0/0 деп алып, артық титрленген, не титрленбей қалған заттың процентік мөлшерін табады. Индикаторлық қате (0,1-0,2)0/0-тен аспаса, не 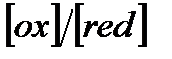 қатынасы
қатынасы 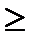 103-не тең, не одан үлкен болса индикатор титрлеуге дұрыс таңдап алынған, деп есептеледі.
103-не тең, не одан үлкен болса индикатор титрлеуге дұрыс таңдап алынған, деп есептеледі.
Мысалы, FeSO4 ерітіндісін K2Cr2O7 ерітіндісімен дифениламин (ДФА) индикаторы қатысында титрлеудің индикаторлық қатесін табайық:1) ерітіндіге Н3РО4 қосылмаған 2) ерітіндіге Н3РО4 қосылған жағдайларда.
Титрлеудің жартылай реакциялары:
Ғе3++ 
 Ғе2+, Е0(Ғе3+/Ғе2+)=0,77В, n=1
Ғе2+, Е0(Ғе3+/Ғе2+)=0,77В, n=1
Cr2O  +14Н++6
+14Н++6 
 2 Cr3++7Н2О, E0(Cr
2 Cr3++7Н2О, E0(Cr  O
O  /Cr
/Cr  )=1.33B, n=6
)=1.33B, n=6
E0ДФА=0,76В, түсі ауысу аралығы (0,73+0,79) В.
1) Н3РО4 қоспай титрлегенде:
ЕЭ.Н.=(0,77+1,33·6)/(1+6)=1,25В
Қатенің таңбасы «-». ЕЭ.Н.> E0ДФА, 1,25>0,76В. Ғе2+ аяғына дейін титрленбей, яғни э.н.-ге дейін индикатор өзінің түсін өзгертеді. Т.с.н.-не сәйкес 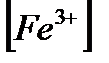 /
/ 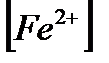 қатынасын табамыз:
қатынасын табамыз:
ЕТ.С.Н.= E0ДФА=0,79В = Е0Ғе3+/Ғе2++0,058 lg(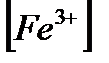 /
/ 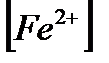 )=0,77+0,058 lg(
)=0,77+0,058 lg(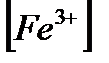 /
/ 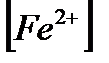 ),
),
бұдан lg(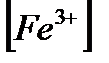 /
/ 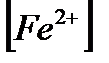 )=0,79-0,77/0,058=0,3;
)=0,79-0,77/0,058=0,3; 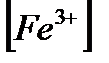 /
/ 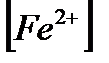 =100,3=2.
=100,3=2.
Сондықтан 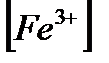 =2
=2 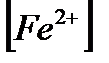 ;
; 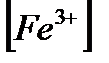 +
+ 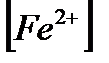 =100%, енді пропорция құрып қатені табамыз:
=100%, енді пропорция құрып қатені табамыз:
( +
+ 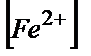 )------100%
)------100%
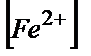 ----c%
----c%
c= 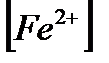 ·100/(
·100/(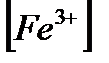 +
+ 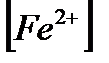 )=
)= 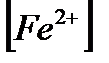 ·100/(2
·100/(2 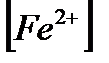 +
+ 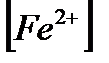 )=100/3=33%
)=100/3=33%
2) Н3РО4 қосып титрлегенде: Е(Ғе3+/Ғе2+)=0,53В; ЕЭ.Н.=(0,53+6·1,33)/7=0,93В.
Қатенің таңбасы «-». ЕЭ.Н.> E0ДФА, 0,93В>0,76В.
ЕТ.С.Н. = E0ДФА =0,79=0,53+0,058 lg 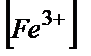 /
/  ;
;
lg(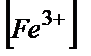 /
/  )=0,79-0,53/0,058=4,4;
)=0,79-0,53/0,058=4,4;  /
/ 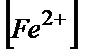 =104,4;
=104,4; 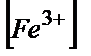 =104,4·
=104,4· 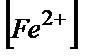
(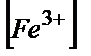 +
+  )------100%
)------100%
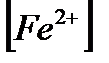 ----c%
----c%
c= 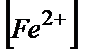 *100/(
*100/( +
+  )=
)=
= 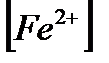 *100/(
*100/(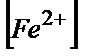 +
+ 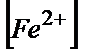 *104,4)=100/1+104,4=0,004%
*104,4)=100/1+104,4=0,004%
10.5. Әдістің практикада қолданылуы
Перманганатометрия әдісі тотықсыздандырғыштарды перманганатпен көбінесе қышқыл ортада тотықтыру реакцияларына негізделген. Қышқылдық ортада:
МnО-4+8Н++5 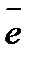
 Мn2++4Н2О; fЭКВ=1/5; E0MnO
Мn2++4Н2О; fЭКВ=1/5; E0MnO  /Mn2+=+1,51В.
/Mn2+=+1,51В.
Калий перманганатының титрленген ерітіндісін тұздың анық нақты мөлшерін алып дайындауға болмайды, себебі пераманганаттың құрамында тотықсыздану нәтижесінде пайда болған МnО2 бар. Сонымен қатар оның судағы ерітіндісі су мен ауадан кіретін әртүрлі қоспалармен (органикалық заттар, тозаң, аммияк т.б.) тотығу-тотықсыздану реакциясына қатысуы нәтижесінде өзінің концентрациясын өзгертеді. Сондықтан перманга-наттың ерітіндісін 7-10 күнге қараңғы жерге қалдырады. Содан кейін КМnО4 ерітіндісін ептеп МnО2 тұнбасынан бөліп алады. Осылай дайындалған КМnО4 ерітіндісінің концентрациясы ұзақ уақыт тұрақты болады. Перманганат ерітіндісінің титрін натрий оксалатын (Na2С2О4) немесе қымыздық қышқылын (Н2С2О4) пайдаланып анықтайды. Перманганат пен қымыздық қышқылы арасындағы реакция – автокаталитикалық реакция:
2МnО4- + 5Н2С2О4 + 6Н+ ® 2Мn2+ + 10СО2 + 8Н2О
С2О42- -2е ® 2СО2; fэкв,(Н2С2О4×2Н2О) = 1/2.
Бұл реакцияда Мn2+ иондары катализатор ролін атқарады. Перманганаттың алғашқы тамшысының бояуы ыстық ерітіндіде де өте баяу жойылады. Титрлеу барысында Мn2+ иондарының концентрациясы артып, реакцияның жылдамдығы да өседі. Перанганатометориялық титрлеуде титранттың өзі индикатор ролін атқарады. Перманганаттың артық мөлшері құйылғанда ерітінді қызғылт түске боялады. Перманганатометория тәжірибеде кең қолданылады. Бұл әдіспен тікелей тотықсыздандырғыштарды титрлеуге болады(Fe2+, Н2О2, NO2- т.б.).
Темірді (II) анықтау. Темір үлгілерін анализге дайындағанда ерітіндіде үш зарядталған темірдің иондары жүреді. Сондықтан титрлеу алдында темір (III)-ті темір (II)-ге дейін тотықсыздандыру керек. Ол үшін әртүрлі тотықсыздандырғыштар пайдаланады: күкіртті сутегі, әртүрлі металдар мен амалгамалар, қалайы (II) хлоридінің ерітіндісі т.б. Тек тотықсыздандырғыштың артық мөлшері титрлеу алдында ерітіндіден түгел кетірілуі керек.
Тәжірибеде кең тараған тотықсыздандырғыштың бірі – SnCl2:
SnCl42- + 2FeCl2+ ® 2Fe2+ + SnCl62- + 2Cl-
Перманганатпен тотығатын SnCl42--тің артық мөлшерін кетіру үшін қалайы (II)-мен әрекеттесетін сулема HgCl2 ерітіндісі қосылады:
2HgCl2 + SnCl42- ® Hg2Cl2 ¯ + SnCl62-
Каломель Hg2Cl2 ақ тұнба түрінде түседі. Тұнбаны сүзбей ақ темір (II)-ні перманганатпен титрлей беруге болады. Бірақ, мына жағдайды еске алу қерек: пайда болған Hg2Cl2 тұнбасы перманганатпен тотығады. Бірақ SnCl42- -дің артық мөлшері аз болса, Hg2Cl2 тұнбасы да аз алынады, сондықтан оның перманганатпен әрекеттесу жылдамдығы болмашы болады. Егер тұнба көп түссе, әсіресе оның әрі қарай тотықсыздануы нәтижесінде металл түрінде сынап пайда болса (тұнба сұрланады):
Hg2Cl2 + SnCl42- ® 2Hg ¯ + SnCl62-
тұнбаның перманганатпен тотығу жылдамдығы артады да, анықтау нәтижесі дұрыс болмайды. Сондықтан дұрыс нәтиже алу үшін SnCl42-–тің шамалы артық мөлшерін ғана қосу керек. Ол үшін H2SnCl4 ерітіндісін тамшылап темір (III) ерітіндісінің сары түсі жойылғанша қосады, содан кейін тағы 1-2 тамшы құяды.
Тағы бір еске алатын жадай – тұз қышқылды ортада Fe (II)-ні перманганатпен титрлегенде қатарласа хлорид иондарының бос хлорға дейін тотығуы. Бұл қатарласу реакциясын жою үшін анализдейтін ерітіндіге Цимерман-Рейнгардтың «қорғаныш қоспасын» қосады. Цимерман-Рейнгардтың қоспасының құрамы – марганец (II) сульфаты, фосфор және күкірт қышқылдары. Марганец сульфаты хлорид-ионының қатарласып тотығуын болдырмайды; фосфор қышқылы темір (III) иондарымен түссіз комплекс [Fe(PO4)2]3- түзіп, эквивалентті нүктені анық табуға мүмкіндік береді; күкірт қышқылы қажетті қышқылдықты қамтамасыз етеді.
Темір (III)-ді тотықсыздандырудың екінші кең тараған жолы – оны металдармен, не олардың амальгамаларымен тотықсыздандыру. Жиі пайдаланатын металл-мырыш:
Zn0 + 2Fe3+ ® 2Fe2+ + Zn2+
Металдың артық мөлшерін сүзіп, оны ерітіндіден жеңіл кетіруге болады. Тотықсызданудың толық жүргендігін аммоний тиоцианатының ерітіндісімен қадағалайды.
Тотықсызданған темір (II) перманганатпен титрленеді. Титрлеу нәтижесінде пайда болған темір (III) сары түсті, бұл түс эквивалентті нүктені анықтауды қиындатады. Эквивлентті нүктені анық табу үшін ерітіндіге темір (III) иондарымен түссіз комплекс беретін фосфор қышқылын қосады.
Тотықтырғыштарды анықтау үшін анализдейтін ерітіндіге концентрациясы белгілі қымыздық қышқылының, не натрий арсенитінің артық мөлшерін қосады. Тотықсыздандырғыштардың артық мөлшерін перманганатпен титрлейді. Мысалы, пиролюзитті анализдегенде үлгіні қымыздық қышқылының күкірт қышқылындағы ерітіндісінде ерітеді:
МnО2 + Н2С2О4 + 2Н+ ® Мn2+ + 2СО2 + 2Н2О
Қымыздық қышқылының артық мөлшері перманганатпен титрленеді.
Орын басу тәсілін пайдаланып перманганатометриялық жолмен тотығу-тотықсыздану қасиеті жоқ, оксалат-ионымен тұнба беретін кальций иондарын да анықтауға болады. Ол үшін кальцийді СаС2О4 тұнбасына айналдырып, тұнбаны сүзеді және жуады. Жуылған тұнбаны күкірт қышқылында ерітеді, ал бөлініп шыққан қымыздық қышқылын перманганатпен титрлейді. Бұл титрлеуде  , себебі онымен байланысқан оксалат-ионы перманганатпен титрлегенде екі электронын жоғалтады: С2О42- -2е ® 2СО2.
, себебі онымен байланысқан оксалат-ионы перманганатпен титрлегенде екі электронын жоғалтады: С2О42- -2е ® 2СО2.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2346; Нарушение авторских прав?; Мы поможем в написании вашей работы!