
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перманганатометрия 1 страница
|
|
|
|
Тарау
Тотығу-тотықсыздану титрлеуі
10.1. Тотығу-тотықсыздану әдісінің сипаттамасы
Титрлеудің тотығу-тотықсыздану титрлеу әдістері тотығу-тотықсыздану реакцияларын пайдалануға негізделген. Тотығу-тотықсыздану әдісінде стандартты титрленген ерітінділер ретінде әртүрлі тотықтырғыштардың және тотықсыздандырғыштардың ерітінділері қолданылады. Белгілі он мыңдаған тотығу-тотықсыздану реакцияларының ішінде титримериялық әдісте тек жылдам, аяғына шейін, қосымша реакцияға қатыспай, белгілі стехиометриялық жолмен жүретін және құрамы белгілі қосылыстар түзетін реакциялар ғана пайдаланылады. Реакцияның толық жүрген-жүрмегенін тепе-теңдік константасының (Кт) мәнімен анықтауға болады. Сандық анализде пайдаланылатын реакциялар үшін Кт≥ 108 болу керек. Тотығу-тотықсыздану реакцияларының бағытын және олардың толық жүргенін анықтайтын мән Кт реакцияға қатысатын жүйелердің стационарлы тотығу-тотықсыздану потенциалдарының айырымына байланысты (9 тарауды қара):
lgКт = (n×(E1 – E2) / 0,058
Сондықтан реакцияны аяғына дейін жүргізу үшін потенциалдар айырымын арттыру керек. Ол үшін көп жағдайда тотығу-тотықсыздану потенциалдарына әсер ететін факторларды пайдалану қажет (9 тарау). Егер тотығу-тотықсыздану жұптарыңдағы жеке компоненттердің концетрациясын өзгертсе, бұл жұптарға сәйкес потенциалдардың мәні де өзгереді, кейде реакцияның бағыты да өзгеруі мүмкін. Мысалы:
1) титриметриялық анализде мысты иодометриялық әдіспен анықтайды:
Cu2+ + 4J- → 2CuJ ↓ + J2 (10.1)
Бұл реакцияға катысатын Cu2+/ Cu+, J2/ 2J- жұптарының потенциалдары Е0(Cu2+/Cu+)=+0,15 В, Е0(J2/ 2J-) = +0,54В. Потенциалдардың мәніне қарағанда (10.1) реакция кері жүруі керек. Бірақ CuJ тұнбасының аз ерігіштігіне байланысты Cu+ ионының концентрациясы өте көп төмендейді:
Е= Е0 + 0,058ℓg([Cu2+] / [Cu+]) (10.2)
ЕКCuJ = [Cu+] × [J-] =1,1×10-12, ЕК теңдігінен [Cu+] = ЕКCuJ/ [J-].
Осы мәнді (10.2) теңдікке қойсақ:
Е= Е0 + 0,058ℓg [Cu2+] – 0,058ℓg (ЕКCuJ/ [J-]) = Е0-0,058ℓg ЕКCuJ + 0,058ℓg [Cu2+] × [J-] = Е01 + 0,058ℓg [Cu2+] × [J-]
Е01= Е0-0,058ℓg ЕКCuJ = 0,15-0,058 ℓg10-12= 0,15+0,70=0,85 В.
Е(Cu2+/ Cu+) = 0,85 В > Е(J2/ 2J-) = +0,54В – болғандықтан (10.1) реакция оң бағытта жүреді.
2) аммиактік ортада Со(II) мөлшерін K3[Fe(CN)6] ерітіндісімен титрлеп анықтауға болады. Со3+/Со2+ жүйесінің потенциалы Е0 (Со3+/Со2+) =1,81 В. Бұл потенциалдың мәні оттегінің потенциалынан (Е0 (О2/Н2О) =1,23 В) артық болғандықтан Со3+ ионы судағы ерітіндіде өте тұрақсыз және ол:
4Со3++2Н2О → О2+4Н++ 4Со2+
реакциясы бойынша суды тотықтырады. Ал аммиакты ерітіндіде кобальт иондары комплекс түзеді де ([Со(NН3)6]3+, [Со(NН3)6]2+), бұл комплекстік қосылыстардың тұрқтылығында өте көп айырмашылық болғандықтан жүйенің потенциалы көп мәнге азаяды:
Е([Со(NН3)6]3+/[Со(NН3)6]2+)=1,81+0,058ℓg(а ох/ а red)+0,058ℓg(Сох/Сred)
Е01= 1,81 + 0,058 ℓg (β[Со(NН3)6]2 +/ β[Со(NН3)6]3+) =
=1,81+ 0,058 ℓg (104/ 1035) =1,81 + 0,058(-31) =1,81-1,80=0,01В.
Е([Fe(CN)6]3- / [Fe(CN)6]4-) = 0,36 В
Со(NН3)6]3+ / Со(NН3)62+ жұбының потенциалы [Fe(CN)6]3-/[Fe(CN)6]4- жұбының потенциалынан төмен болғандықтан титрлегенде мынандай реакция жүреді:
Со(NН3)62+ + Fe(CN)63- ↔ Со(NН3)6]3+ + Fe(CN)64-
Көптеген тотығу-тотықсыздану реакциялары баяу жүреді, олардың жылдамдығы титриметрияға қажетті жылдамдыққа сәйкес келмейді. Мұндай жағдайда реакцияны жылдамдату амалдарын жасау керек:
1. Қыздыру.
Мысалы, сурьма (III) бромат-ионымен тұз қышқылы ортасында комнатты температурада өте баяу тотығады. Егер температураны 70-80˚С –қа дейін көтерсе, реакцияның жылдамдығы жеткілікті мөлшерге дейін артады. Осыған байланысты сурьманы броматометриялық әдіспен анықтауға болады:
3Sb (III) + BrO- 3 + 6H+ = 3 Sb (V) + Br- + 3H2O
2. Ерітіндінің қышқылдығын өзгерту. Мысалы, перманганатометрия, хроматометрия әдістері МnO4- пен Cr2O72- иондарының қышқылдық ортадағы тотықтырғыш әсеріне негізделген:
МnO4- +5e + 8Н+ = Мn2+ + 4H2O
Cr2O72- +6e + 14Н+ = 2Cr2+ + 7H2O
3. Катализаторлар пайдалану.
Мысалы, церийді екі зарядталған темірдің стандартты ерітіндісімен титрлеу үшін Се3+ иондарын K2S2O8 ерітіндісімен катализатор ретінде Ag+, не Со2+ иондарын пайдаланып Се (IV) –ке дейін тотықтырады. Персульфат күміс (I) ионын күміс (II) –ге дейін тотықтырады. Күміс (II) церий (III) ионын церий (IV) –ке дейін тотықтырады, пайда болған күміс (I) тағы персульфатпен тотығады да, цикл қайталанады:
S2O8-
Ag+ Ag2+
Ag2+ + Се3+ Се4+ + Ag+
Артық қалған персульфатты ерітіндіні қайнатып бұзады:
2 S2O8- + 2H2O → 2 SO42- + О2 + 4Н+
Содан кейін: Се (IV) + Fe2+ → Се3+ + Fe3+
Кей жағдайда катализатор реакцияның нәтижесінде пайда болады (автокатализ). Алғашқыда:
5 C2O42- + 2 МnO4- + 16Н+ = 2Мn2+ + 8H2O + 10СО2
реакциясы өте баяу жүреді. Жүйеде Мn2+ ионының белгілі мөлшері пайда болғанда реакцияның жылдамдығы артады, себебі Мn2+ ионы МnO4- -пен әрекеттесіп аралық Мn3+ және МnO2+ иондарын түзеді, ал бұл иондар оксалат анионын тотықтырады.
Мn2+ + МnO4- → МnO2+ + МnO3-
Мn2+ + МnO3- → МnO2+ + МnO2-
МnO2- +4Н+ → Мn3+ + 2H2O
Пайда болған аралық бөлшектер оксалат анионымен әрекеттесіп:
МnO2+ + C2O42- → Мn2+ + СО2
Мn3+ + C2O42- → Мn2+ + СО2
реакцияны жылдамдатады.
Реакция нәтижесінде пайда болатын химиялық активті, косымша реакцияларға қатыса алатын аралық қосылыстар анализді күрделендіреді. Мысал ретінде темірді перманганатометриялық жолмен анықтауды қарастыруға болады:
5 Fe2+ + МnO4- + 8Н+ → 5Fe3+ + Мn2+ + 4H2O (10.3)
Бұл реакцияны тұз қышқылы қатысында жүргізгенде пермаганаттың шығыны күкірт қышқылды ортада жүргізгеннен көп болады. Оның себебі перманганаттың бір бөлігі хлор-ионын тотықтыруға жұмсалады:
2MnO4- + 10Cl- +16H+ → 2Мn2+ +5Cl2 + 8H2O (10.4)
Ерітіндіде темір (II) болмағанда /10.4/ реакция жүрмейді. Өз бетімен жеке жүрмейтін, бірақ басқа бір реакция жүргенде сонымен қоса жүретін реакцияны Н.А. Шилов индуцирленген, не қатарласқан реакция деп атады. Темір (II) мен перманганат әрекеттескенде марганецтің тұрақсыз аралық тотығу дәрежесі бар иондары пайда болады: Mn(VI), Mn(IV), Mn(III). Бұл химиялық активті бөлшектер темір (II) иондарымен қатар хлор-иондарымен де бос хлор (CI2) түзіп әрекеттеседі. Пайда болған CI2 газ түрінде ерітіндіден ұшып кетеді, сондықтан тұз қышқылды ортада реакцияға перманганаттың артық мөлшері жұмсалады. Ерітіндіде Mn (III) –пен тұрақты комлекс түзетін сульфат-, фосфат-иондары жүрсе, Mn(III)/Mn(II) жұбының потенциалы Mn(III) пен хлор-иондарының арасында реация жүрмейтін мәнге дейін кемиді, бірақ бұл мән  Fe(II)- ні Fe(III)-ке дейін тотықтыруға жеткілікті. Индуцирленген реакция Mn(II) иондары көп мөлшерде жүрсе де басылады. Сондықтан Fe(II) иондарын фосфор қышқылы, күкірт қышқылы, марганец сульфаты қоспаларының қатысында перманганатпен титрлесе, хлорид-ионының қатарласып тотығу реакциясы жүрмейді және титрлеу дұрыс нәтиже береді.
Fe(II)- ні Fe(III)-ке дейін тотықтыруға жеткілікті. Индуцирленген реакция Mn(II) иондары көп мөлшерде жүрсе де басылады. Сондықтан Fe(II) иондарын фосфор қышқылы, күкірт қышқылы, марганец сульфаты қоспаларының қатысында перманганатпен титрлесе, хлорид-ионының қатарласып тотығу реакциясы жүрмейді және титрлеу дұрыс нәтиже береді.
Қазіргі уақытта 50-ден артық тотығу-тотықсыздану титрлеу әдістері белгілі. Көбінесе әдіс пайдаланылатын тотықтырғыштың атымен аталады. Мысалы, перманганатометрия-титрант KMnO4 ерітіндісі, дихроматометрия-титрант K2Cr2O7 ерітіндісі, иодометрия- титрант I2 мен Na2S2O3 ертінділері, броматометрия-титрант KBrO3 ерітіндісі, цериметрия-титрант Ce(SO4)2 ерітіндісі т.б.
Tотығу-тотықсыздану титрлеуін тікелей, кері, орынбасу тәслідерімен жүргізуге болады.
10.2. Tотығу-тотықсыздану индикаторлары
Tотығу-тотықсыздану әдісінде екі түрлі индикаторлар белгілі 1) спецификалық (арнайы) индикаторлар-титрлеуге қатысатын бір компонентпен химиялық реакцияға қатысатын зат және 2) жүйенің тотығу-тотықсыздану потенциялының өзгеруіне сезімтал тотығу-тотықсыздану индикаторлары.
Ең белгілі спецификалық индикатор крахмал болып есептелінеді. Крахмал үшиодид (I3-) ионымен қою-көк түсті комплекс түзеді. Осы комплекстің пайда болуы реакцияның нәтижесінде иодтың бөлінуі, не жұмсалуына негізделген титрлеудің соңғы нүктесін анықтауға мүмкіншілік береді. Тағы да бір спецификалық индикатор - ол калий роданиді. Роданидтің қатысында темір(III) ионын титан(III) сульфаты ерітіндісімен титрлеуге болады. Титрлеудің соңғы нүктесі темір(III)-роданид комплексінің қызыл бояуының жойылуына сәйкес келеді.
Титрант ретінде KMnO4 ерітіндісін пайдаланғанда индикатор ролін титранттың өзі атқарады. Титрлеудің аяғына жеткенде KMnO4-тің құйылған артық мөлшері ерітіндіні қызғылт түске бояйды.
Tотығу-тотықсыздану индикаторлары-жүйеде белгілі тотығу-тотықсыздану потенциалы пайда болғанда тотығып, не тотықсызданып түсін шұғыл өзгертетін заттар.
Индикатордың жартылай реакциясын былай жазуға болады:
Indox+ne=Indred
егер индикаторлық реакция қайтымды болса:
E=E0+(0.059/n)·lg·([Indox]/[Indred])
Индикатордың бір түрінің бояуының екінші түрінің бояуына өзгеруі оның екі түрінің концентрацияларының бір-біріне қатысы ([Indox]/[Indred]) · 1/10, не 10/1 тең болғанда көрінеді. Бұл мәндерді Нернст теңдеуіне қойып индикатордың түсін толық өзгерту жағдайын, яғни түсін өзгерту аралығын табуға болады:
E=E0+(0.059/n) ·lg10-1=E0- 0.059/n (Indred бояуы)
E=E0+(0.059/n) ·lg10=E0 + 0.059/n (Indox бояуы)
Сондықтан индикатордың түсін өзгерту аралығы:
DE=E0 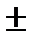 0.059/n.
0.059/n. 
Индикатордың түсін өзгерту потенциалы оның стандартты потенциалына байланысты. 10.1 – кестеде кейбір индикаторлардың сипаттамалары берілген.
10.1 – кесте
Кейбір жиі пайдаланылатын тотығу-тотықсыздану индикаторлары
| Индикатор | Бояуы | Стандартты потенциал Е0, В | Жағдайы | |
| Тотыққан түрі | Тотықсыздан-ған түрі | |||
| Темірдің 5-нитро-1,10-фенантролинаты | Көк | қызыл | +1,25 | IM H2SO4 |
| 2,3-дифениламино-карбон қышқылы | күлгін | түссіз | +1,12 | 7-10M H2SO4 |
| Фенилантронил қышқылы | қызыл | түссіз | +1,08 | IM H2SO4 |
| Дифениламин | Көк | түссіз | +0,76 | IM H2SO4 |
| Метиленді көк | Көк | түссіз | +0,53 | IM қышқыл |
Tотығу-тотықсыздану индикаторлары ішінде өзінің түсін потенциал өзгергенде қайтымды өзгертетін индикаторлар және қайтымсыз тотығатын, не тотықсызданатын индикаторлар да бар. Жиі пайдаланылатын қайтымды индикаторлардың бірі – дифениламин (ДФА). Дифениламин алғашқыда тотықтырғыштардың әсерінен қайтымсыз түссіз дифенилбензидинге дейін тотығады:
2C6H5-NH- C6H5 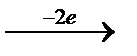 C6H5-NH-C6H4- C6H4-NH- C6H5
C6H5-NH-C6H4- C6H4-NH- C6H5
дифениламин (түссіз) дифенилбензидин (түссіз)
Содан кейін қайтымды тотығу-тотықсыздану реакциясына қатысып көк түсті дихинондиамин түзеді:
C6H5-NH-C6H4-C6H4-NH-C6H5 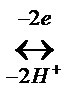 C6H5-N=C6H4=C6H4=N-C6H5
C6H5-N=C6H4=C6H4=N-C6H5
дифенилбензидин (түссіз) дихинондиамин (көк)
Бұл реакция күшті қышқыл ортада (pH O) қайтымды, E0=+0.76 B.
Индикатордың түсін өзгерту аралығы:
E1=0.76-0.059/2=0.73 B, E2=0.76+0.059/2=0.79 B.
Титрлеуге 0,5 г дифениламиннің 100 мл концентрлі күкірт қышқылы мен 20 мл судың қоспасында еріген ерітіндісі пайдаланылады.
Фенилантронил қышқылы (ФАҚ)–дифениламиннің карбонилді туындысы, Е0=1,08 В. Индикатордың түсін өзгерту аралығы Е1  Е2=1,02
Е2=1,02  1,14 В.
1,14 В.
C6H4СООН-NH- C6H4-Н+ 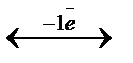 C6H4СООН-N=С6Н5
C6H4СООН-N=С6Н5
Түссіз көк
Индикатордың 0,005 М натрийлі тұзындағы сулы ерітіндісі пайдаланылады.
Tотығу-тотықсыздану индикаторы ретінде темір (II)-дің орта-фенилантронилді комплексі (ферроин) де қолданылады. Индикатор ретінде осы лигандтың басқа туындыларымен түзетін комплекстері де пайдаланылады.
Tотығу-тотықсыздану титрлеуін жүргізгенде таңдап алған индикатордың түсін өзгерту аралығы титрлеу қисығының эквивалентті бөлігіне сәйкес келуі керек.
10.3. Титрлеу қисығы
Tотығу-тотықсыздану титрлеу қисығын (Е-V) кординатында құрады, себебі тотығу-тотықсыздану жүйесінің потенциалы Нернст теңдігі бойынша концентрациялардың қатысының логарифміне тәуелді. Титрлеу қисығын (Е-V) координатында құру қисықтың эквивалентті бөліміне сәйкес потенциал аралығын табуға мүмкіндік береді, осыған сәйкес қажетті индкаторды таңдап алу жеңілденеді.
Титрлегенде титрант пен анықтайтын заттың тотығу-тотықсыздану жұбына сәйкес потенциалдары өзгереді:
E=E0+(0.058/n) ·lg( /
/  )
)
Мысалы, 25,00 мл 0,100М FeSO4 ерітіндісін 0.100М Ce(SO4)2 ертіндісімен титрлеуін қарастырайық. Тотығу-тотықсыздану титрлеуінде титрлеу қисығының алғашқы нүктесін есептемейді, оның себебі ерітіндіде анықтайтын заттың бірақ түрі жүреді (Fe2+), ал екінші түрінің концентрациясы өте аз және белгісіз. Сондықтан потенциалды титрантты құйғаннан кейін ғана есептей бастайды.
Титрлегенде жүретін реакция:
Fe2++Ce4+ ® Fe3++Ce3+
Эквивалентті нүктеге дейін жүйенің потенциалы титрлейтін зат жұбының (Fe3+/ Fe2+) потенциалымен анықталады:
E=E0+(0.058/n)·lg(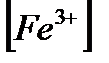 /
/ 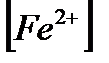 )
)
Ерітіндіге титранттың 1,00 мл құйсақ нәтижесінде (эквивалентінің молярлы концентрациялары тең болғандықтан) сонша мл Fe3+ пайда болады:
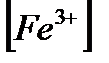 = VСе4+ × ССе4+ =1,00 мл × 0,100М;
= VСе4+ × ССе4+ =1,00 мл × 0,100М;
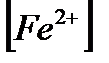 =
=  =25,00×0,100-1,00×0,100=24,00×0,100;
=25,00×0,100-1,00×0,100=24,00×0,100; 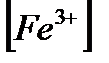 /
/ 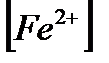 =1,0/24,0;
=1,0/24,0;
Е= 0,77+0,058×lg(1,0/24,0)=0,69 В.
Титрлеу нәтижесі 10,2 кестеде келтірілген.
Эквивалентті нүктеде жүйенің потенциалы ерітіндіде жүрген екі тотығу-тотықсыздану жұбының потенциалымен анықталады: Fe3+/Fe2+ және Се4+/Се3+. Сондықтан бұл потенциал екі жұптың потенциалдарының қосындысына сәйкес болады:
Е(Ғе3+/Ғе2)++Е(Се4+/Се3+)=Е0(Ғе3+/Ғе2+)+0,058 lg×( /
/  )+
)+
+Е0(Се4+/Се3+)+0,058 lg×(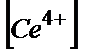 /
/  )=
)=
=Е0(Ғе3+/Ғе2+)+Е0(Се4+/Се3+)+0,058lg×(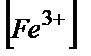 /
/ 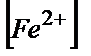 )×(
)×(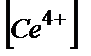 /
/ 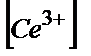 ).
).
Титрлеудің кез-келген нүктесінде 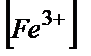 =
=  , ал эквивалентті нүктеде
, ал эквивалентті нүктеде  =
= 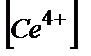 . Осыдан:
. Осыдан:
( /
/ 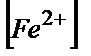 )*(
)*( /
/ 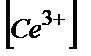 )=1,2Е= Е0(Ғе3+/Ғе2+)+ Е0(Се4+/Се3+), себебі lg1=0
)=1,2Е= Е0(Ғе3+/Ғе2+)+ Е0(Се4+/Се3+), себебі lg1=0
Еэ.н.= [(Е0(Ғе3+/Ғе2+)+ Е0(Се4+/Се3+)]/2=(0,77+1,44)/2=1,105 В.
Күрделі тотығу-тотықсыздану жүйесін алсақ, мысалы:
5Ғе2++МnО-4+8Н+  5Ғе3++Мn2++4Н2О (10.5)
5Ғе3++Мn2++4Н2О (10.5)
Е(Ғе3+/Ғе2+)= Е0+0,058lg(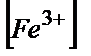 /
/  )
)
E(MnO  /Mn2+=E0+(0.058/5)lg(
/Mn2+=E0+(0.058/5)lg( *
*  8/
8/ 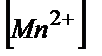 )=E0-
)=E0-
-0.058/5×8pH+(0.058/5×)lg( /
/  )=
)=
=E01+(0.058/5)×lg(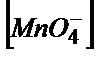 /
/ 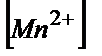 );
);
E01= E0-(0.058/5)×8pH.
Екінші теңдікті бір электронға келтірсек:
5E(MnO  /Mn2+)=5Е
/Mn2+)=5Е  +0,058 lg(
+0,058 lg( /
/ 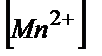 )
)
6Е=Е0(Ғе3+/Ғе2+)+5Е  +0,058lg·(
+0,058lg·( /
/  )·(
)·( /
/  ); Эквивалентті нүктеде (10.5) реакциясы үшін: [Fe2+]=5[MnO
); Эквивалентті нүктеде (10.5) реакциясы үшін: [Fe2+]=5[MnO  ], [Fe3+]=5[Mn2+], сондықтан:
], [Fe3+]=5[Mn2+], сондықтан:
6Е= Е0(Ғе3+/Ғе2+)+5Е  , Е= (Е0(Ғе3+/Ғе2+)+5Е
, Е= (Е0(Ғе3+/Ғе2+)+5Е  )/6, не жалпы түрде:
)/6, не жалпы түрде:
Еэ.н.= (n1·E  +n2·E
+n2·E  )/(n1+n2).
)/(n1+n2).
Эквивалентті нүктеден кейін ерітіндіде титранттың тотығу-тотықсыздану жұбы пайда болады – Се4+/Се3+, жүйенің потенциалы осы жұптың потенциалымен анықталады:
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2104; Нарушение авторских прав?; Мы поможем в написании вашей работы!