
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы для подготовки к экзамену
|
|
|
|
Белки
Каучуки
Натуральный каучук получают из млечного сока гевеи; это изопреновый каучук со стереорегулярным строением:
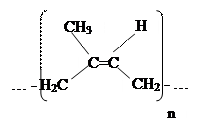
Группы –СН2 в макромолекуле находятся по одну сторону от двойной связи в каждом звене, т.е. в цис – положении. Такое расположение СН2 – групп способствует естественному скручиванию макромолекулы в клубок, что и обусловливает высокую эластичность каучука. При нагревании каучука с серой (вулканизации) атомы серы вступают во взаимодействие с молекулами каучука по месту некоторых двойных связей и как бы «сшивают» их друг с другом. Полимер приобретает пространственную структуру и становится прочнее невулканизированного.
Бутадиеновый синтетический каучук. Сырьём для получения бутадиена служит этиловый спирт; в основе метода лежат реакции дегидрирования и дегидратации спирта:
CH2 – CH – H + H – CH – CH- H → CH2=CH – CH= CH2 + 2H2O + H2
│ │ │ │
H OH H OH
Cтроение бутадиенового каучука выражается формулой:
-(СН2 – СН=СН – СН2)n-
Однако, в условиях химического синтеза стереорегулярное строение не получалось, и это отражалось на свойствах. В настоящее время получен бутадиеновый каучук стереорегулярного строения. Чтобы отличить его от бутадиенового, не имеющего регулярного строения, его называют дивиниловым.
Установлено, что в результате гидролиза любого белка получается смесь α-аминокислот. Согласно полипептидной теории, молекулы белка представляют длинные цепи остатков α-аминокислот, соединённых пептидными (амидными) связями. Например:
H2N – CH2 – COOH + H- N – CH – COOH →
Глицин │ │
Н СН3
Аланин
→ H2N – CH2 – C – N –CH – COOH + H2O
║ │ │
О Н СН3
Дипептид
Вариант 1
18. Как объяснить: а) отсутствие летучести у высокомолекулярных соединений; б) вязкость их растворов; в) что прочность линейных полимеров с увеличением длины макромолекулы возрастает?
19. Относительная молекулярная масса бутадиенового каучука равна 80 000 – 450 000. Определите степень полимеризации бутадиенового каучука.
Вариант 2
18. Полиэтилен высокого давления имеет относительную молекулярную массу 45 000, а полиэтилен низкого давления – 300 000. Определите степень полимеризации полиэтилена.
19. Какими признаками должны характеризоваться вещества, вступающие в реакцию: а) полимеризации; б) поликонденсации?
Вариант 3
18. Нитрон, или акрилон, - синтетическое волокно, заменяющее шерсть, получают из акрилонитрила СН2=СН-СN. Составьте схему получения полиакрилонитрила.
19. Масса макромолекулы, полученной в результате полимеризации, равна сумме масс образовавших её молекул. Распространяется ли это утверждение на вещества, полученные поликонденсацией? Ответ поясните.
Вариант 4
18. Изопентан, извлекаемый из попутного нефтяного газа, используется в промышленностидля синтеза изопрена – мономера изопренового каучука. Получают изопрен путём реакции дегидрогенизации изопентана в присутствии катализаторов избирательного действия. Написать уравнение данного процесса.
19. Установлено, что, чем больше различие в молекулярной массе макромолекул полимера, тем шире температурный интервал, в котором он плавится, и наоборот. Объясните это явление.
Вариант 5
18. Полиэтилен с молекулярной массой около 500 представляет собой вязкую жидкость. Вычислите степень полимеризации такого полиэтилена.
19. Полиамидное волокно энант, отличающееся от капрона большей светостойкостью, получается из продукта поликонденсации аминоэнантовой кислоты H2N – (CH2)6 – COOH. Составьте уравнение поликонденсации этой кислоты.
Вариант 6
18. Полимеризацией изобутилена получают высокомолекулярное вещество – полиизобутилен. Составьте уравнение реакции полимеризации изобутилена. Укажите структурное звено полимера.
19. Полимеризацией хлорпрена CH2=CH – C = CH2 получают хлоропреновый
|
Cl
каучук, характеризующийся высокой устойчивостью к действию света, теплоты и растворителей. Составьте уравнение полимеризации хлоропрена и формулу структурного звена полимера.
Вариант 7
18. Вычислите степень полимеризации полипропилена, приняв среднюю молекулярную массу его равную 100 000.
19. Совместной полимеризацией бутадиена–1,3 и стирола получают бутадиен-стирольный каучук, обладающий высокой механической прочностью. Составьте уравнение реакции сополимеризации, приняв во внимание регулярное чередование в макромолекуле звеньев, образованных исходными веществами, и формулу структурного звена сополимера.
Вариант 8
18. Подобно этилену, формальдегид может полимеризоваться по месту двойной связи в молекуле. При этом образуется полиформальдегид с чередующимися в цепи атомами углерода и кислорода. Полимер обладает хорошими механическими свойствами и используется для изготовления деталей машин, пленок, волокон и т.п. Составьте схему реакции полимеризации формальдегида, укажите формулы структурного звена и образующегося полимера.
19. Совместной полимеризацией бутадиена–1,3 и нитрила акриловой кислоты CH2=CH – C ≡ N получают бутадиен-нитрильный каучук, стойкий к растворителям – бензину, керосину и другим углеводородам. Составьте уравнение реакции сополимеризации и приведите структурную формулу этого каучука.
Вариант 9
18. При нагревании выше 200°С полистирол деполимеризуется. Составьте уравнение реакции деполимеризации.
19. Фторпроизводное этилена содержит по массе 24% углерода. Плотность этого соединения по водороду равна 50. Выведите формулу этого соединения и составьте уравнение реакции его полиеризации.
Вариант 10
18. Можно ли обломки деталей, изготовленных из текстолита, вновь переработать в монолитное изделие методом горячего прессования. Ответ поясните.
19. Рассчитайте степень поликонденсации наволочной фенолформальдегидной смолы, если средняя относительная молекулярная масса равна 648.
1. Периодическая система Д.И.Менделеева. Изменение свойств элементов в периодах и группах.
2. Строение атома.
3. Понятие «химическая связь». Ионная связь.
4. Металлическая связь. Водородная связь.
5. Ковалентная связь. Метод валентных связей.
6. Понятие «система» и «внешняя среда». Функции состояния. Первый закон термодинамики.
7. Энтальпия. Закон Гесса.
8. Самопроизвольные процессы. Энтропия. Второй закон термодинамики.
9. Энергия Гиббса.
10. Скорость химической реакции в гомогенных системах. Колебательные реакции.
11. Методы регулирования скорости химической реакции.
12. Катализ.
13. Фазовое равновесие. Правило фаз Гиббса.
14. Растворы.
15. Растворы электролитов. Активность.
16. Диссоциация кислот, солей и оснований в воде.
17. Ионное произведение воды. рН раствора.
18. Обменные реакции в растворах электролитов, идущие с образованием слабых электролитов.
19. Обменные реакции в растворах электролитов, идущие с образованием труднорастворимого вещества и газов.
20. Растворимость. Произведение растворимости.
21. Гидролиз. Соли, образованные сильным основанием и слабой кислотой.
22. Гидролиз. Соли, образованные слабым основанием и сильной кислотой.
23. Гидролиз. Соли, образованные слабым основанием и слабой кислотой.
24. Окислительно-восстановительные реакции. Окислители. Восстановители.
25. Классификация окислительно-восстановительных реакций.
26. Оксиды.
27. Кислоты.
28. Основания.
29. Соли.
30. Неметаллы. Общая характеристика, в том числе окислительно –восстановительные свойства.
31. Кислородные и водородные соединения неметаллов.
32. Щелочные металлы.
33. Щелочно – земельные металлы.
34. Металлы IIIА и IVА подгрупп.
35. Металлы VA и VIA подгрупп.
36. Общая характеристика d – элементов.
37. Химические свойства d –металлов.
38 Полимеры. Классификация полимеров. Термопластичность, термореактивность.
39 Полимеризация. Цепная полимеризация.
40 Ионная полимеризация. Поликонденсация.
41 Основные положения макромолекулярной теории.
42 Химическая идентификация вещества. Общие понятия.
43 Методы проведения аналитических реакций.
44. Количественный анализ. Химические методы. Аналитические реакции. Критерии пригодности химической реакции как основы аналитического метода.
45. Гравиметрический метод.
46. Титриметрический метод.
47. Инструментальные методы анализа. Теоретические основы оптических методов анализа.
48. Абсорбционно-спектральные методы. Закон Ламберта-Бугера-Бера.
49. Эмиссионные спектральные методы. Люминесцентные методы.
50. Электрохимические методы. Потенциометрия.
51. Электрохимические методы. Вольтамперометрия. Кондуктометрия.
52. Адсорбция.
53 Хроматография.
Список литературы
а) основная литература
1. Коровин Н.В. Общая химия. - М.: Высшая школа, 2007.
2. Никольский А.Б., Суворов А.В. Химия. – СПб.: Химиздат, 2007.
3. Гуров А.А., Овчаренко Л.П. Химия. – М.: изд.МГТУ им. Н.Э.Баумана, 2004.
б) дополнительная литература
1. Глинка Н.А. Общая химия. - Л.: Химия, 2005.
2. Угай А.Я. Общая и неорганическая химия. - М.: Высшая школа, 1997.
3. Хаускрофт К., Констебл Э. Современный курс общей химии. В 2-х т. – М.: Мир, 2002.
4. Задачи и упражнения по общей химии. Под ред. Н.В. Коровина - М.: Высшая школа, 2004.
5. Задачи и упражнения по общей химии. Под ред. Н.А. Глинки Н.В. - Л.: Химия, 1984.
6. Практикум по неорганической химии. Бабич Л.В., Балезин С.А., Гликина Ф.Б. и др. – М.: Просвещение, 1991.
7. Васильева З.Г., Грановская А.А., Таперова А.А.. Лабораторные работы по общей и неорганической химии. – Л.: Химия, 1986.
ПРИЛОЖЕНИЯ
Таблица 1
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 3884; Нарушение авторских прав?; Мы поможем в написании вашей работы!