
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства ферментов
|
|
|
|
ФЕРМЕНТЫ
Ферменты могут иметь различное строение: они могут состоять только из белка, обладающего каталитическими свойствами, или же из белка – апофермента и небелковой части - простетической группы.
Если простетическая группа, легко отделяется от белковой части молекулы фермента, ее называют коферментом. Коферменты непосредственно участвуют в реакции, катализируемой ферментом, а белковая часть молекулы – апофермент - определяет специфичность реакции на этапе связывания субстрата.
В молекуле каждого фермента выделяют активный центр (АЦ) – это та часть молекулы фермента, к которой присоединяется субстрат. На АЦ приходится малая часть объема молекулы фермента.
В составе АЦ фактически следует различать участок, ответственный за присоединение субстрат - центр связывания и каталитический центр, который воздействует на субстрат, заставляя его вступать в реакцию и изменяться. В каталитических центрах большей части известных ферментов обычно находят один или несколько остатков из числа следующих аминокислот (АК): серин (ser), цистеин (cys), лизин (lys), тирозин (tyr), гистидин (his), называемых функциональными группами, которые непременно сближены в пространстве, а в линейной последовательности полипептида могут располагаться достаточно далеко друг от друга.
Коферменты, как правило, выполняют функцию каталитического центра.
Химическая природа коферментов очень разнообразна.
В качестве коферментов чаще всего могут выступать соединения нуклеотидной природы, например АТФ. Функцию коферментов могут выполнять витамины, сложные структуры с сопряженными связями, например, группа ГЕМ в молекуле гемоглобина; ионы металлов, например Zn2+, Mg2+, Mn2+, Ca2+, Fe2+, Cu2+, Mo2+.
Каждый фермент характеризуется таким показателем, как активность. За единицу активности принимают количество фермента, которое в стандартных условиях катализирует превращение 1 мкМоля субстрата в 1 минуту.
Кроме того, в 1972 г. было предложено выражать ферментативную активность в каталах. Катал - это количество фермента, катализирующее превращение 1 Моля субстрата в 1 секунду.
Существует понятие удельной активности. Это активность фермента, отнесенная к его молекулярной массе, если таковая известна (Е/мг белка, Е/мл белка).
Свойства ферментов:
1. Термолабильность. Ферменты - термолабильные вещества, чувствительные к изменению температуры. Температура, при которой каталитическая активность максимальна - называют температурным оптимумом (Тopt). Тopt большинства ферментов животного происхождения лежит в интервале 40-50оС, а растительного - 50-60оС. Однако, встречаются ферменты с Тopt = 80оС. При повышении температуры выше Тopt фермент инактивируется, т.е. его активность снижается вплоть до исчезновения. Инактивация ферментов связана с разрушением третичной структуры апофермента и разобщением групп активного центра. В результате субстрат не может связаться с активным центром фермента.
2. Влияние рН среды. На активность фермента оказывает влияние концентрация ионов водорода. Для каждого фермента существует свое оптимальное значение рН, при котором его активность максимальна. Отклонение значения рН от оптимального вызывает понижение активности фермента вплоть до его полной инактивации.
Фермент рНopt Функция
Пепсин 1.5-2.0 гидролиз белка
Трипсин 7.8-8.5 гидролиз белка
Липаза 4.7-5.0 гидролиз жиров
3. Специфичность. Специфичность. Она заключается в том, что каждый фермент может катализировать одну или несколько близких по своей природе реакций.
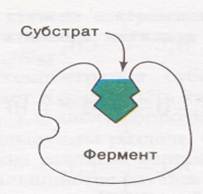
Еще в 1890 г. Эмиль Фишер предсказал, что «фермент должен подходить субстрату, как ключ к замку». Это означает, что фермент может катализировать превращение субстрата, если имеет место соответствие пространственных конфигураций формы молекулы субстрата активному центру фермента. Такое соответствие часто называют сродством.
Однако значительно позднее Кошланд высказал идею об индуцированном соответствии пространственных конфигураций активного центра фермента субстрату, что впоследствии подтвердилось. При связывании субстрата происходит изменение формы фермента. Активный центр фермента только после присоединения субстрата становится комплементарным ему по форме.
Специфичность ферментов условно подразделяют на: Относительную специфичность - ею обладают ферменты, которые действуют на соединения, имеющие определенный тип связей. Например, протеиназы действуют на пептидную группу. Это ферменты широкого спектра действия.
|
Групповая специфичность - характерна для ферментов, которые действуют на субстраты, имеющие одинаковый тип связи и одну из функциональных группировок. Это могут быть:
фосфомоноэстеразы, гидролизующие лицетины на фосфатидную кислоту и спирт холин.
Абсолютная специфичность - ею обладают ферменты, действующие только на один субстрат с вполне определенной структурой.
К ферментам, обладающим абсолютной специфичностью относятся уреаза, катализирующая превращение карбамида (мочевины) до углекислого газа и воды, ацетилхолинэстераза и др.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 5401; Нарушение авторских прав?; Мы поможем в написании вашей работы!