
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение (1.11) с учетом (1.12) примет
|
|
|
|
Тогда давление газа, оказываемое им на стенку сосуда
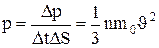 . (1.11)
. (1.11)
Если газ в объеме V содержит N молекул, движущихся со скоростями 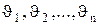 , то целесообразно рассматривать среднюю квадратичную скорость
, то целесообразно рассматривать среднюю квадратичную скорость
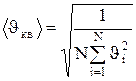 , (1.12)
, (1.12)
характеризующую всю совокупность молекул газа.
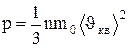 . (1.13)
. (1.13)
Выражение (1.13) называется основным уравнением молекулярно - кинетической теории идеальных газов. Точный расчет с учетом движения молекул по всевозможным направлениям дает ту же формулу.
Учитывая, что 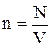 , получим
, получим
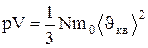 (1.14)
(1.14)
или
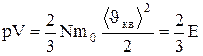 , 0.15)
, 0.15)
где Е - суммарная кинетическая энергия поступательного движения всех молекул газа.
Так как масса газа m=Nm0, то уравнение (1.14) можно переписать в виде
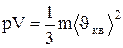 .
.
Для одного моля газа m=M (M - молярная масса), поэтому
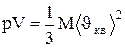 ,
,
где Vm - молярный объем. С другой стороны, по уравнению Клапейрона-Менде-леева, pVm = RT. Таким образом,
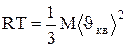 ,
,
откуда
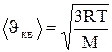 . (1.16)
. (1.16)
Так как М=m0NA, где m0 - масса одной молекулы, NA - постоянная Авогадро, то из уравнения (1.16) следует, что
 , (1.17)
, (1.17)
где 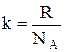 - постоянная Больцмана. Отсюда найдем, что при комнатной температуре молекулы кислорода имеют среднюю квадратичную скорость 480 м/с, водорода - 1900 м/с. При температуре жидкого гелия те же скорости будут соответственно 40 и 160 м/с.
- постоянная Больцмана. Отсюда найдем, что при комнатной температуре молекулы кислорода имеют среднюю квадратичную скорость 480 м/с, водорода - 1900 м/с. При температуре жидкого гелия те же скорости будут соответственно 40 и 160 м/с.
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа
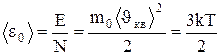 (1.18)
(1.18)
пропорциональна термодинамической температуре и зависит только от нее. Из этого уравнения следует, что при Т=0 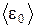 =0, т.е. при 0° К прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газами формула (1.18) раскрывает молекулярно-кинетическое толкование температуры.
=0, т.е. при 0° К прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газами формула (1.18) раскрывает молекулярно-кинетическое толкование температуры.
1.4. Закон Максвелла для распределения
молекул идеального газа по скоростям
При выводе основного уравнения молекулярно-кинетической теории молекулам задавали различные скорости. В результате многократных соударений скорость каждой молекулы изменяется по модулю и направлению. Однако из-за хаотического движения молекул все направления движения молекул являются равновероятными, т.е. в любом направлении в среднем движется одинаковое число молекул.
По молекулярно-кинетической теории, как бы не изменялась скорость молекул при столкновениях, средняя квадратичная скорость молекул массой m0 в газе, находящемся в состоянии равновесия при T=const, остается постоянной и равной 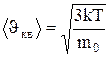 . Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем, распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон теоретически выведен Дж.Максвеллом.
. Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем, распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон теоретически выведен Дж.Максвеллом.
При выводе закона распределения молекул по скоростям Максвелл предполагал, что газ состоит из очень большого числа N тождественных молекул, находящихся в состоянии беспорядочного движения при одинаковой температуре. Предполагалось также, что силовые поля на газ не действуют.
Закон Максвелла описывается некоторой функцией f( ), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные d
), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные d  , то на каждый интервал скорости будет приходиться некоторое число молекул dN(
, то на каждый интервал скорости будет приходиться некоторое число молекул dN( ), имеющих скорость, заключенную в этом интервале. Функция f(
), имеющих скорость, заключенную в этом интервале. Функция f( ) определяет относительное число
) определяет относительное число
молекул 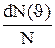 , скорости которых лежат в интервале от
, скорости которых лежат в интервале от  до
до  +d
+d  , т.е.
, т.е.
 ,
,
откуда
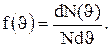
Применяя методы теории вероятности, Максвелл нашел функцию
f( )- закон для распределения молекул идеального газа по скоростям:
)- закон для распределения молекул идеального газа по скоростям:
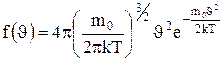 . (1.19)
. (1.19)
Из (1.19) видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т).
График функции (1.19) приведен на рис. 51.
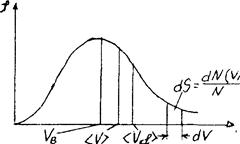
Рис. 51
Он подтвержден экспериментально опытом Штерна. Т.к. при возраста-
нии  множитель
множитель 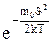 уменьшается быстрее, чем растет множитель
уменьшается быстрее, чем растет множитель  2, то функция f(
2, то функция f( ), начинаясь от нуля, достигает максимума при
), начинаясь от нуля, достигает максимума при  В и затем асимптотически стремится к нулю. Кривая несимметрична относительно
В и затем асимптотически стремится к нулю. Кривая несимметрична относительно  В.
В.
Относительное число молекул 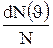 , скорости которых лежат в интервале от
, скорости которых лежат в интервале от  до
до  +d
+d  , находится как площадь более светлой полоски на рис.51. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что функция f(
, находится как площадь более светлой полоски на рис.51. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что функция f( ) удовлетворяет условию нормировки
) удовлетворяет условию нормировки 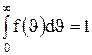 .
.
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью. Значение наиболее вероятной скорости можно найти продифференцировав выражение (1.19) по аргументу  , приравняв результат нулю и используя условия для максимума выражения f(
, приравняв результат нулю и используя условия для максимума выражения f( ):
):
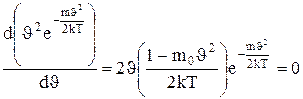 .
.
Значения  =0 и
=0 и  =¥ соответствуют минимумам выражения (1.19), а
=¥ соответствуют минимумам выражения (1.19), а
значение  , при котором выражение в скобках становится равным нулю,
, при котором выражение в скобках становится равным нулю,
и есть искомая наиболее вероятная скорость  В:
В:
 . (1.20)
. (1.20)
Из формулы (1.20) следует, что при повышении температуры максимум функции распределения молекул по скоростям (рис. 52) сместится вправо.
 Рис. 52
Рис. 52
| Однако площадь, ограниченная кривой, остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться.
Средняя скорость молекулы <  > >
|
(средняя арифметическая скорость) определяется по формуле
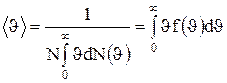 .
.
Подставляя сюда f( ) и интегрируя, получим
) и интегрируя, получим
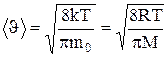 . (1.21)
. (1.21)
Скорости, характеризующие состояние газа: наиболее вероятная скорость
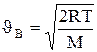 ;
;
средняя 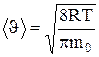 =1,13
=1,13 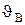 ;
;
средняя квадратичная 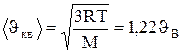 (рис.51).
(рис.51).
1.5. Среднее число столкновений и средняя длина
свободного пробега молекул
Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между этими последовательными столкновениями молекулы проходят некоторый путь l, который называется длиной свободнго пробera. В общем случае длина пути между последовательными столкновениями различна, но т. к. мы имеем дело с огромным числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул < 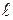 >.
>.
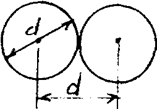 Рис. 53
Рис. 53
| Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d (рис.53). Он зависит от скорости сталкивающихся молекул, т.е. от температуры газа. |
Так как за 1 с молекула проходит в среднем путь, равный средней арифметической скорости <  >, и если < z > - среднее число столкновений, испытываемых одной молекулой газа за 1 с, то средняя длина свободного пробега
>, и если < z > - среднее число столкновений, испытываемых одной молекулой газа за 1 с, то средняя длина свободного пробега
 .
.
Для определения < z > представим себе молекулу в виде шарика диаметром d, которая движется среди других "застывших" молекул.
Эта молекула столкнется только c теми молекулами, центры котоpыx находятся на расстояниях, равных или меньших d, т.е. лежат внутри "ломаного" цилиндра радиусом d (pис. 54).
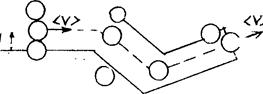
Рис. 54
Среднее число столкновений за 1 с равно числу молекул в объеме "ломаного" цилиндра:
<z> = nV,
где n - концентрация молекул, V=pd2 <  > (<
> (<  > - средняя скорость молекулы или путь, пройденный ею за 1 с). Таким образом, среднее число столкновений
> - средняя скорость молекулы или путь, пройденный ею за 1 с). Таким образом, среднее число столкновений
<z>=npd2<  >.
>.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 383; Нарушение авторских прав?; Мы поможем в написании вашей работы!