
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 2 Уравнение
|
|
|
|
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
в краткой ионной форме будет иметь следующий вид:
Mn7+O42- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
Из двух полуреакций окислительные свойства будет проявлять та из них, потенциал которой более положителен.
окисленная форма восстановленная форма
 (I) Mn7+O42- + 8H+ + 5
(I) Mn7+O42- + 8H+ + 5 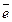 ® Mn2+ + 4H2O, E0Mn7+/Mn2+ = 1,51 B
® Mn2+ + 4H2O, E0Mn7+/Mn2+ = 1,51 B
(II) Fe3+ + 1 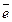 ® Fe2+, E0Fe3+/Fe2+ = 0,77 B
® Fe2+, E0Fe3+/Fe2+ = 0,77 B
Следовательно, при контакте система I выступит в качестве окислителя, а система II в качестве восстановителя. Иными словами, первая реакция протекает слева направо, т.е. ионы MnO4- восстанавливаются до ионов Mn2+, а вторая реакция протекает справа налево, т.е. ионы Fe+2 окисляются до ионов Fe3+.
ЭЛЕКТРОЛИЗ. ЗАКОНЫ ФАРАДЕЯ
Электролиз - процесс раздельного окисления и восстановления на электродах, осуществляемый при прохождении постоянного электрического тока через раствор или расплав электролита.
При электролизе происходит превращение электрической энергии в химическую.
Ячейка для электролиза, называемая электролизером, состоит из двух электродов и электролита между ними. Продукты, выделяющиеся на электродах, могут вступать между собой в химическое взаимодействие, поэтому анодное и катодное пространство разделяют диафрагмой. Электрод, на котором идет реакция восстановления (катод), подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока. Электролиз подчиняется законам Фарадея.
При электролизе могут быть использованы активные (растворимые) и инертные (нерастворимые) аноды.
Активный анод окисляется и посылает в раствор собственные ионы, которые восстанавливаются на катоде. Например, при электролизе раствора СuSO4 с медным (растворимым) анодом происходят следующие реакции:
СuSO4 <=> Сu2+ + SO42-
Катод (-) Сu анод (+)
Сu2+ + 2ē → Сu° Сu° - 2ē → Сu2+
Активные аноды изготовляются из меди, серебра, цинка, никеля и других металлов.
В качестве инертных анодов обычно используют графит и платину.
Инертный анод является лишь передатчиком электронов, а сам химически не изменяется.
Например, при электролизе расплава хлорида натрия с применением графитовых электродов происходят следующие химические реакции:
NaCl <=> Nа+ + Сlˉ
катод (-) анод (+)
Na+ + ē → Nao 2Clˉ - 2ē → С12
Суммарная реакция NаС1 → Nа + 1/2С12
Методом электролиза расплавленных солей в заводских условиях
получают щелочные и щелочноземельные металлы (Мg, Nа, Li, К, Са, Ве), алюминий, а также газообразные хлор и фтор.
В следующем случае, при наличии в растворе нескольких типов катионов и анионов на катоде в первую очередь должны восстанавливаться те катионы, которым отвечает наиболее положительное значение электродного потенциала (Е°).
На аноде, соответственно, должны окисляться анионы с наиболее отрицательным значением электродного потенциала (Е°).
При электролизе водных растворов электролитов электродные процессы осложняются за счет конкуренции ионов (в электролизе могут участвовать ионы воды).
Н2О <=> Н+ + ОНˉ
Восстановительный процесс на катоде в водных растворах имеет следующие особенности:
1) Катионы металлов со стандартным электродным потенциалом, большим, чем у водорода, почти полностью восстанавливаются на катоде и выделяются в виде металла.
2) Катионы металлов с малой величиной электродного потенциала от Li+, Nа+, К+,.…. до Аl3+, включительно, при электролизе на катоде не восстанавливаются, вместо них восстанавливаются молекулы воды:
2Н2О + 2ē = Н2 +2ОНˉ ; 2Н+ + 2ē → Н2
3) Катионы металлов со стандартным электродным потенциалом
большим, чем у алюминия (Мn2+,Сг3+,Fе2+.... до Н) на катоде восстанавливаются одновременно с молекулами воды, вследствие явления перенапряжения на катоде, т.е. реальные процессы осложняются за счет перенапряжения при электролизе (∆Е).
В идеальных условиях осуществления электролиза необходимо приложить противоположную по знаку ЭДС гальванического элемента.
Однако реальные электрохимические процессы осложняются явлениями кинетического характера (диффузия ионов, адсорбция их и т.д.).
Для преодоления этих кинетических затруднений необходимо приложить добавочную ЭДС, которая и называется перенапряжением.
∆Е = Еразл - Ео,
где Е° - равновесная ЭДС соответствующего гальванического элемента;
Еразл - общее прилагаемое к электролитической ячейке напряжение, при котором начинается процесс электролиза.
При выделении на электродах газообразных продуктов Н2, О2 величина ∆Е велика, а при выделении металлов (кроме железа и никеля) величина ∆Е мала, и в первом приближении ею можно пренебречь.
Водородное перенапряжение позволяет электрохимически выделить на катоде более активные металлы (находящиеся в ряду напряжений между алюминием и водородом, имеющие более отрицательный по сравнению с водородом потенциал). Например, при электролизе кислых растворов солей цинка на цинковом катоде должен был бы выделяться водород, так как
Е°Н2/2Н+ =0.00 В, а Е°Zn/Zn+2 = - 0.76 В. Но величина водородного перенапряжения на цинке - порядка 0.7 В, что близко к стандартному электродному потенциалу цинка, для которого перенапряжение практически равно 0. Это приводит к совместному выделению на катоде водорода и цинка.
То есть катодное перенапряжение можно рассматривать как дополнительное напряжение, прикладываемое к катоду (при этом происходит смещение потенциала катода далее в отрицательную сторону).
Анодное перенапряжение - это дополнительное напряжение, прикладываемое к аноду (при этом потенциал анода смещается далее в положительную сторону).
На нерастворимом аноде в процессе электролиза водных растворов
происходит окисление анионов или молекул воды по уравнению:
2Н2 О - 4ē → О2 + 4Н+; 4ОН¯ - 4ē →2Н2О + О2
При электролизе водных растворов бескислородных кислот и их
солей, кроме НF и фторидов (ввиду положительного значения электродного потенциала фтор не может быть выделен на аноде и его получают электролизом расплавленных фторидов), на аноде будут окисляться анионы
(Iˉ, S 2-, Brˉ, Clˉ).
Например, при электролизе СuВr2 на электродах произойдут следующие процессы:
СuВr2 <=> Сu2+ + 2Вr¯; Н2О <=> Н+ + ОН¯
на катоде: Сu2+ + 2ē → Сu°; Е° = 0.337 В
2Н2O + 2ē → Н2 + 2OН¯; Е° = - 0.83 В
на аноде: 2Вr¯ - 2ē → Вr2°, Е° = 1.08 В
2Н2O - 4ē → O2 + 4Н+ ; Е° = 1.228В
Так как потенциал перехода Сu/Сu2+ значительно больше, на катоде
будет происходить восстановление ионов меди. Потенциал перехода 2Вrˉ/Вr2
меньше, следовательно, на аноде будут окисляться, преимущественно, ионы брома до свободного брома.
При электролизе кислородосодержащих кислот и их солей (SO42-,
NO3-, PO43-) на аноде окисляются молекулы воды с выделением кислорода, т.к. потенциал окисления воды будет значительно меньше, чем для таких анионов. Например:
2SO42- - 2ē = S2O82-, Е° = 2.01 В
2Н2O - 4ē = O2 + 4Н+, Е° = 1.228 В:
Анионы, содержащие металл в промежуточной степени окисления (SO32-, NO2-), сами окисляются на аноде, например:
SO32- + Н2O - 2ē = SO42- + 2Н+
Процесс электролиза широко применяется в различных областях современной техники.
Электролизом солей с нерастворимыми анодами получают (гидрометаллургия) металлы: Сu, Zn, Сd, Ni, Со, Mn и другие. Метод электролиза с растворимым анодом используется для рафинирования (очистки) металлов: Сu, Аu, Аg, Ni, Со, РЬ и Sn.
Электролиз используется для нанесения металлических покрытий
на металлы и пластмассы (гальванические покрытия).
Электролиз в химической промышленности используется для получения многих ценных продуктов: Н2 и O2, Cl2 и NaОН, F2 и НF, Н2O2, КМnО4, органических веществ и т.д. Электролизом получают "тяжелую воду".
Большое значение имеют электрохимические способы синтеза различных органических соединений.
Окислительно-восстановительные процессы на морском флоте используют для полировки металлов и нанесения прочных защитных оксидных пленок (оксидирование), для обессоливания воды, для электрохимической заточки режущих инструментов и т. д.
С учетом современной терминологии законы Фарадея можно записать в следующем виде:
1) масса образующегося при электролизе вещества прямо пропорционально количеству прошедшего электричества:
m = Mэ · Iτ / 96500,
где m - масса вещества окисленного или восстановленного на электроде;
Мэ - молярная масса эквивалентов;
I - сила тока, А;
τ - продолжительность электролиза, с;
F - число Фарадея; F = 96500 Кл /моль·экв;
2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Лекция 7
КОРРОЗИЯ МЕТАЛЛОВ. СПОСОБЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ.
- Определение и классификация коррозионных процессов по условиям протекания, типу разрушения, механизму протекания.
- Химическая и электрохимическая коррозия. Виды коррозии, встречающиеся в судовой практике.
- Методы защиты от коррозии: легирование, защитные покрытия, электрохимическая защита. Изменение свойств коррозионной среды. Ингибиторы коррозии.
1. Определение и классификация коррозионных процессов по условиям протекания, типу разрушения, механизму протекания.
Коррозия-это разрушение металлов в результате химического или электрохимического и биологического воздействия окружающей среды. При этом металлы окисляются и образуются продукты коррозии, состав которых зависит от условий коррозии.
В соответствии с законами химической термодинамики коррозионные процессы протекают самопроизвольно и необратимо:
Me0 – nē ® Me n+,
что определяется отрицательным значением величины изобарно-изотермического потенциала (∆G) для большинства соединений металла. Чем ниже величина (∆G), тем сильнее стремление металла к коррозии. Приближенно судить о степени нестабильности различных металлов в растворах электролитов можно по величине стандартного электродного потенциала металла (E0, В). Термодинамическая устойчивость металла к коррозии возрастает с ростом Е0 и зависит от характера коррозионной среды.
Кинетика, т.е. реальная скорость коррозионного процесса также определяет устойчивость металла к коррозии; фактором, тормозящим коррозию, может быть наличие на поверхности металла различных оксидных или солевых пленок, обуславливающих медленность доставки агрессивных компонентов среды к поверхности металлов и отвода продуктов реакции.
В зависимости от условий протекания коррозионых процессов различают следующие виды коррозии:
1. атмосферная коррозия – коррозия металла в атмосфере воздуха или других влажных газов;
2. жидкостная – коррозия металла в электролитах;
3. грунтовая (подземная) – коррозия металла в почвах и грунтах;
4. электрокоррозия – коррозия под действием блуждающих токов или внешнего источника тока;
5. щелевая – коррозия в щелях и зазорах металлических конструкций;
6. коррозия под механическим напряжением;
7. биологическая коррозия.
Коррозионный процесс влияет на практически важные свойства металлов и потому важно знать тип коррозионного разрушения.
Различают два вида коррозии:
-сплошную или общую (чистые металлы или однофазные сплавы), которая ответственна за безвозвратные потери металла, но практически не влияет на механические свойства металла;
-местную или локальную, которая опасна в инженерно-техническом плане, снижая надежность работы аппаратуры, конструкций, сооружений и т.д. К разновидностям местной коррозии относят питтинг, межкристаллитную коррозию и коррозионное растрескивание (коррозия при одновременном воздействии химических реагентов и высоких механических напряжений).
По механизму протекания коррозионного процесса, зависящему от характера внешней среды, с которою взаимодействует металл, различают химическую и электрохимическую коррозию.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 449; Нарушение авторских прав?; Мы поможем в написании вашей работы!