
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алканы
|
|
|
|
Соли алюминия сильных кислот (AlCl3, Al(NO3)3, Al2(SO4)3) в растворе гидролизуются с образованием кислой среды, соли слабых кислот, например, Al2S3, Al2(СO3)3, гидролизуются полностью и в водном растворе не существуют.
Очень широкое применение находят некоторые сплавы алюминия – дюралюминий (дюраль). Из сплава алюминия с магнием (магналия) изготавливают конструкции морских и речных судов, танкеры для перевозки продуктов питания; сплавы алюминия с магнием и кремнием (пеналюминий) применяют в строительстве.
Очень важным является применение алюминия для алитирования – насыщения поверхности стальных или чугунных изделий алюминием.
AlCl3 – хлорид алюминия - является катализатором при переработке нефти и в различных органических синтезах; с помощью Al2(SO4)3 очищают воду от взвешенных частиц и бактерий.
Низкая температура плавления галлия (29,8°С) и высокая температура кипения (2237°С) позволяют применять этот металл для изготовления высокотемпературных термометров и для получения легкоплавких сплавов.
Таллий используют в полупроводниковой технике, из индия изготавливают высококачественные зеркала прожекторов.
Еще менее очевидным становится сходство между элементами в группе IV А (С, Si, Ge, Sn, Pb). Углерод представляет собой неметалл, который почти всегда образует 4 ковалентные связи с другими элементами. Кремний – неметалл, обладающий некоторыми металлическими свойствами, включая серебристый блеск. Германий относится к числу металлоидов, а олово и свинец – металлы. С, Si, Ge образуют соединения преимущественно с ковалентной связью. Оксиды углерода (IV) и кремния (IV) – кислотные оксиды; оксиды германия, олова, свинца – амфотерные.
Олово и свинец – элементы IV группы периодической системы имеют (s²р²) электронную структуру внешнего уровня, проявляют положительные степени окисления +4 и +2. Существует олово в двух модификациях – белое олово и серое, явление превращения белого олова при температурах ниже 14°С в серое получило название оловянной чумы. Свинец – аналог олова, тяжелый металл. Он очень мягок и режется ножом. Олово и свинец с кислородом образуют оксиды МеО и МеО2, свинец может образовывать смешанные оксиды Pb3О4 (сурик) и Pb2О3.
С водой металлы Sn и Pb практически не реагируют, разбавленные соляная и серная кислоты почти не действуют на них; это связано со значительным перенапряжением выделения водорода на металлах. Растворяются металлы в концентрированных кислотах: H2SO4, HNO3, HCl.
Sn + 4H2SO4 = Sn(SO4)2 + 2SO2 + 4H2O
конц.
Pb + 3H2SO4 = Pb(HSO4)2 + SO2 + 2H2O
конц.
Sn + 4HNO3 = H2SnO3 + 4NO2 + H2O
β – оловянная кислота
Олово и свинец растворяются в щелочах с образованием гидроксостаннитов К2[Sn(OH)4] и гидроксоплюмбитов К2[Pb(OH)6].
Гидроксиды этих металлов Ме(ОН)2 и Ме(ОН)4 обладают амфотерными свойствами; с увеличением степени окисления металлов нарастают кислотные свойсва у гидроксидов. Известны α- и β-оловянные кислоты Н2SnO3 и ее соли – станнаты Na2SnO3; соли несуществующей в свободном состоянии свинцовой кислоты – плюмбаты.
Соединения двухвалентного олова и свинца - восстановители, четырехвалентные - окислители. Олово и свинец идут на получение сплавов (баббиты, припои и др.).
Олово используют для покрытия им изделий из железа, соприкасающихся с продуктами питания. Наибольшее количество свинца расходуется на изготовление оболочек кабелей и пластин аккумуляторов для защиты от γ-излучений при работе с радиоактивными веществами.
Атомы элементов V А группы (N, P, As, Sb, Bi) имеют на внешнем уровне по пять электронов (s²р³), из которых неспарены три
р-электрона. Такому состоянию отвечает степень окисления -3, например, в гидридах ЭН3. При возбуждении атомов валентных электронов становится 5 в состоянии s¹р³d¹ возбуждения, которому отвечает степень окисления элементов в соединениях +5.
Азот и фосфор чаще всего имеют степени окисления –3, +3 и +5. Для мышьяка и сурьмы наиболее важным является состояние окисления +3. Для висмута оно единственно возможно.
Азот и фосфор – типичные неметаллы, у мышьяка преобладают неметаллические свойства, у сурьмы в равной мере выражены неметаллические и металлические свойства, у висмута преобладают металлические свойства.
Сурьма и висмут при обычных условиях устойчивы к окислению на воздухе, к действию воды, но при нагревании активность их повышается, и они могут реагировать с галогенами. Оксиды сурьмы (III) и висмута (III) амфотерны:
Bi2O3 + 6KOH = 2K3BiO3 + 3H2O
Bi2O3 + 6HCl = 2BiCl3 + 3H2O
Многие соединения этой подгруппы обладают полупроводниковыми свойствами.
В группе VI А (О, S, Se, Te, Po) на внешнем уровне атомов этих элементов по шесть электронов (s²р4).
Кислород проявляет валентность равную 2, т.к. во внешнем уровне атома кислорода нет d-подуровня, а остальные элементы данной группы - валентности 2, 4, 6.
Окислительная активность элементов этой группы выражена сильнее, чем у элементов V А группы.
У элементов группы VII А утрачиваются все металлические свойства: все галогены – типичные неметаллы.
Полимеры, применяемые на морском флоте.
Многие полимерные материалы обладают ценными химическими и физическими свойствами и успешно применяются на морском флоте.
В качестве конструкционных материалов на морском флоте применяются как сами полимеры, так и изготовленные на их основе пластмассы.
Основой пластических масс являются высокомолекулярные вещества. Кроме того, пластические массы могут содержать наполнители, пластификаторы, отвердители, инициаторы, ингибиторы, красители, смазывающие вещества и т. д.
Наполнители (древесная мука, ткань, бумага, древесный шпон, асбестовое и стеклянное волокно и др.) придают пластмассе требуемые механические свойства. Благодаря пластификаторам (камфара, диметилфталат и некоторые растворители) устраняется хрупкость материала, облегчается обработка. Смазочные вещества (олеиновая кислота, стеарат кальция) устраняют прилипание материала к пресс-форме при изготовлении изделия. Красители, растворимые в пластмассе, придают ей тот или иной цвет.
Пластмассы трудно растворимы и, если растворяются, то в ограниченном числе растворителей. Некоторые из них почти совсем нерастворимы (например, тефлон). Растворы пластмасс обладают значительной вязкостью.
Лишь немногие из пластмасс, например, капрон, имеют достаточно четкую точку плавления, большинство постепенно переходит из стеклообразного в высокоэластичное и вязкотекучее состояние.
По отношению к нагреванию пластмассы разделяют на термореактивные и термопластичные.
Термореактивными называются такие пластмассы, которые при нагревании в процессе изготовления из них изделий вследствие «сшивания» макромолекул полимера поперечными связями превращаются в нерастворимые, неплавкие материалы. При нагревании до высоких температур термореактивные материалы разлагаются, но не плавятся.
Термопластичными называются материалы, которые при нагревании размягчаются, химически не изменяясь, и вновь затвердевают при охлаждении. В отличие от термореактивных пластмасс термопласты обычно растворимы в таких органических растворителях, как спирт, ацетон, бензол, и в некоторых других.
Свойства пластмасс зависят от свойств их составляющих и, прежде всего, от свойств и строения полимеров. Определить качественный состав полимеров можно физико-химическими способами.
В связи с тем, что большинство пластмасс содержат наполнители, пластификаторы и другие добавки, могут являться смесями полимеров или сополимерами, анализ и распознавание пластических масс является очень сложным процессом. Тем не менее в большинстве случаев по ряду признаков можно отнести пластмассы к определенным категориям. К таким признакам следует отнести внешний вид, цвет, твердость, температуру размягчения, растворимость в тех или иных растворителях. Важным способом распознавания пластмасс является нагревание или сжигание в пламени спиртовки и изучение выделяющихся при этом продуктов. Из термопластичных полимеров широко применяют полиметилметакрилат, полистирол, полиэтилен, винипласт, полиизобутилен, капрон, фторопласт-4 (политетрафторэтилен); из термореактивных - фенопласты, получаемые на основе фенолформальдегидной смолы; аминопласты, получаемые на основе мочевиноформальдегидной смолы; полиэфирные, эпоксидные и кремнийорганические полимеры.
Получение синтетических полимеров осуществляется в результате реакций полимеризации и поликонденсации.
Полимеризацией называют процесс присоединения друг к другу большого числа одинаковых мономерных молекул с образованием молекул высокомолекулярного вещества.
Полимеризация является межмолекулярной реакцией присоединения и не сопровождается выделением каких-либо побочных продуктов. Мономер и продукт его полимеризации имеют один и тот же элементарный состав.
Полимеризация протекает путем насыщения главных валентностей исходных мономерных молекул в результате разрыва в них двойных или тройных связей (>С=С<; >С=О; -N=C<; -C=С-; -С≡N) или раскрытия цикла, например в трехчленных циклических окисях и аминах:
>С-С< >С-С<
\/ \/
C N
/\ ½
Полимеризация может протекать по двум направлениям. Ступенчатая полимеризация происходит путем последовательного, ступенчатого образования, димера, тримера и т.д., что обусловлено перемещением атома водорода на каждой стадии процесса, например:
R
½
R - СН=СН2 + R-CH=CН2 ®R-СH2 –СН2 -С=СН2 и т.д.
По типу ступенчатой полимеризации происходит образование многих синтетических полимеров - параформальдегида, полиэтиленоксида и др. Ступенчатое течение процесса полимеризации обуславливает в большинстве случаев образование полимеров со сравнительно невысокой молекулярной массой.
Цепная полимеризация протекает с раскрытием двойных связей и присоединением молекул друг к другу, например:
R-CH=CH2 +CH=CН2 ® CH-CH2 -CН-CН2 - и т.д.
½ ½ ½
R R R
Энергия, необходимая для перехода молекулы в активное состояние, получается ею в результате воздействия световых лучей, электрического разряда, применения инициаторов (различные перекиси) и катализаторов.
При цепной полимеризации рост цепи полимера до предельной в данных условиях величины происходит очень быстро - почти мгновенно. Поэтому неуклонное повышение вязкости полимера обязано лишь увеличению концентрации мономера в полимере.
Путем цепной реакции полимеризации получается большинство важных синтетических полимеров - полиэтилен, полиизобутилен, полистирол, винилиты, акриловые смолы и др.
Однако, в реакциях цепной полимеризации можно вводить также молекулы двух различных, но подобных по структуре веществ. Такая совместная полимеризация, называемая сополимеризацией, нашла большое применение в технике, так как позволяет получать сополимеры, обладающие новыми ценными свойствами. Сополимер бутадиена (75%) и стирола (25%), а также сополимер бутадиена (60-75%) и акрилонитрила (25-40%) представляет собой синтетические каучуки – буна-S и, соответственно, буна-N; сополимер изобутилена (95%) и дивинила (5%) - бутил-каучук - способен к вулканизации, тогда как полимер изобутилена не вулканизируется; сополимеры хлористого винила и хлористого винилидена представляют собой легко прессующиеся пластичные материалы для получения изделий, отличающихся высокой механической прочностью и устойчивостью к действию химических реагентов.
Большой интерес представляют также следующие типы сополимеров, имеющие важное практическое значение - блок-сополимеры и привитые сополимеры.
Полимеризация может происходить самопроизвольно, но, как правило, этот процесс проводится в присутствии катализаторов (щелочных и щелочноземельных металлов, меди, железа, хлорида цинка, хлорида алюминия, хлоридов олова и меди, фтористого бора, оксидов кремния, алюминия, меди, металлорганических соединений, активированного угля и др.) или инициаторов (перекисей и гидроперекисей органических и минеральных кислот).
Принципиальная схема цепного процесса полимеризации:
1. M1 →M*2 образование активного центра, инициирование цепи:
 М 1* +М 1→М 2*
М 1* +М 1→М 2*
2.М 2* +М 1→М 3* рост цепи
М *n-1+М 1→М *n
3. Мn* → Mn обрыв цепи,
где M1 - молекула мономера; M1* - активный центр; М2*, М3*, Mn-1*, Мn* - радикалы; Мn - молекула полимера.
Активными центрами реакции цепной полимеризации могут быть свободные радикалы - электронейтральные частицы, имеющие свободный электрон, например, образующийся при термическом распаде органической перекиси
R-CO-O
½ → 2R-CO-O 
R-СО-O
или ионы.
В зависимости от характера активных центров различают радикальную или ионную полимеризацию.
Конденсацией называется процесс образования нового соединения из двух или большего числа молекул исходных веществ, сопровождающихся отщеплением некоторых простых молекул - водорода, кислорода, азота, галоида, галоидоводорода, солей галоидоводородной кислоты, воды, аммиака, спирта, кислоты и др.
Конденсация, применяемая для получения высокомолекулярных соединений, называется поликонденсацией.
Процессы конденсации и поликонденсации возможны лишь в том случае, когда исходные вещества содержат реакционноспособные группы.
В реакцию поликонденсации могут вступать как одинаковые молекулы, содержащие две различные функциональные группы, например, аминокислоты, оксикислоты и др. (гомополиконденсация), так и различные по составу молекулы (гетерополиконденсация),
Если соответственные реакционноспособные группы содержатся в одной и той же молекуле, то возможна также внутримолекулярная конденсация с замыканием цикла.
Скорость поликонденсации зависит от условий ее проведения -температуры, скорости удаления отщепляющихся молекул воды, солей галоидоводородных кислот и др., поэтому, как правило, реакция проводится при нагревании, иногда в присутствии катализаторов. Рост цепи - ступенчатый: растущая цепь последовательно реагирует с молекулами исходных веществ. Вследствие этого реакции поликонденсации протекают довольно медленно, без выделения тепла и требуют нагревания. На любой ступени процесса продукты поликонденсации представляют собой полидисперсную смесь цепей различной величины.
Длина цепей поликонденсата зависит от того, насколько полно удаляются из реакционной массы отщепляющиеся молекулы воды, солей галоидоводородных кислот и др. Если они не удаляются, то наступает равновесное состояние и рост цепи прекращается. Теоретически считается возможным образование бесконечно длинных цепей. Ниже приводится несколько типов реакций поликонденсации:
- Получение сложных полиэфиров.
При поликонденсации многоосновных кислот с многоосновными спиртами получаются высокомолекулярные сложные полиэфиры, известные под названием алкидных смол.
xНООС(СН2)n СООН + хНО(СН2)m ОН →(2х - 1)Н2O +
+ НО [- ОС(СН2)n COO(СН2)mO-]xН
Из полиэфиров дикарбоновых кислот и многоатомных спиртов получают различные пленки, а также пластмассы; многие из них нашли применение в производстве лаков.
-Получение полиамидов.
Полиамиды синтезируют из диаминов и двухосновных кислот. Полиамиды, образующиеся при поликонденсации алифатических диаминов (от этилен - до декаметилендиамина) с алифатическими двухосновными кислотами (от щавелевой до себациновой), обладают очень ценными свойствами образовывать пленки и правильные нити. При соответствующей обработке получают весьма прочные и эластичные нити и пленки, не боящиеся воды. Полиамиды этого типа называются «найлон». Для производства найлона служат адипиновая кислота и гексаметилендиамин, которые легко получаются следующими реакциями:
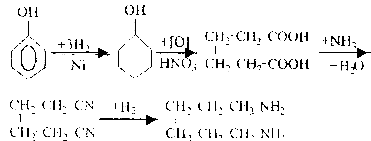
Нагреванием адипиновой кислоты с гексаметилендиаминамином в автоклаве получают найлон:
nНООС(СН2)4СООН +nH2N(CH2)6NH2 → 2nH2O +
+ [-CO-(СН2)4-СО-NH-(CH2)6-NH-]n
-Получение фенолформальдегидных смол.
Из конденсационных смол первое место в современной технике по распространенности, тоннажу и значению занимают фенолформальдегидные смолы. Пластмассы, изготовляемые на их основе в промышленности, называют фенопластами, бакелитами, карболитами.
Фенолформальдегидные смолы получаются при поликонденсации фенолов (фенол, крезолы, ксиленолы) или их производных с формальдегидом.
Для ускорения реакции взаимодействия фенола с формальдегидом применяют катализаторы, обычно кислоты и щелочи. В обоих случаях реакции идут с большими скоростями, но приводят к образованию различных типов смол: термореактивных или термопластичных.
На характер получаемых фенолформальдегидных смол сильно влияет соотношение между исходными продуктами: изменяя соотношение между фенолами и формальдегидом, можно получить либо термопластичные, либо термореактивные смолы.
Реакция взаимодействия фенолов с формальдегидом представляет собой сложный химический процесс, протекающий в несколько стадий с образованием ряда промежуточных продуктов, химическая природа которых в настоящее время строго не установлена. Однако, выяснено, что в начальной стадии процесса в результате присоединения молекулы формальдегида к молекуле фенола образуется орто- и пара-оксибензиловые спирты:
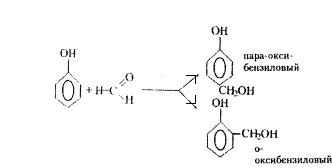
Образовавшиеся многоатомные фенолоспирты способны с легкостью образовывать пространственные полимеры. Следует отметить, что скорости процессов конденсации очень сильно зависят от среды, в которой они протекают - кислотной или щелочной.
В кислой среде фенолоспирты быстро конденсируются друг с другом с образованием линейных полимерных молекул. В щелочной среде фенолоспирты сравнительно устойчивы, дальнейшая реакция их может протекать лишь при высоких температурах.
И так, в кислой среде при соотношении фенола к формальдегиду не менее 1:1 образуются термопластичные (постоянно плавкие и растворимые) смолы. Их называют новолачными смолами или новолаками. Название они получили такое потому, что успешно заменили дефицитную смолу шеллак, которая ранее широко использовалась в электротехнической промышленности для приготовления лаков. Суммарная реакция образования новолачной смолы протекает по схеме:


|

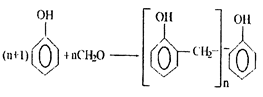
Новолачные смолы представляют собой смесь макромолекул с молекулярными массами от 200 до 1200. В зависимости от молекулярной массы новолака значение n может изменяться от 4 до 8.
Если конденсацию проводят в щелочной среде при избытке формальдегида, то получают термореактивные (резольные) смолы, содержащие свободные метилольные группы:
В начальной стадии поликонденсации, когда молекулярная масса равна 70, 100, резольные смолы легко плавятся и растворимы в органических растворителях, например, в этиловом спирте. При растворении резолов образуются так называемые бакелитовые лаки, клеи (например, клей БФ). При дальнейшей поликонденсации (например, при повышении температуры в процессе прессования) резолы превращаются в неплавкие и нерастворимые резиты, имеющие трехмерное сетчатое строение:

Исследование строения резитов представляет чрезвычайно трудную задачу, так как они не плавятся и не растворяются.
УГЛЕВОДОРОДЫ НЕФТИ.
Нефть является естественным жидким топливом. Главными элементами, из которых состоят все компоненты нефти, являются углерод (83 - 87%) и водород (11,5 - 14%). Наряду с углеродом и водородом во всех нефтях присутствует сера, азот и кислород, суммарное содержание которых составляет обычно 2 - 6%.
В соответствии с элементарным составом основная масса нефти представлена углеводородами различных классов; алканами; циклоалканами (в основном, производными циклопентана и циклогексана); ароматическими, а также смешанными (парафино - нафтено -ароматическими). Помимо углеводородов в нефтях присутствуют также их производные: сернистые, кислородные, азотистые соединения и смолисто - асфальтовые вещества.
Многообразие органических соединений объясняется способностью атомов углерода соединяться друг с другом в длинные цепочки и замкнутые циклы. При образовании химических связей может происходить Sp3 -, Sp2 - или Sp -гибридизация атомных орбиталей углерода
S
| | P | ||
| | | |
При Sp3 - гибридизации возникают 4 равноценные орбитали и каждый атом углерода образует 4 ковалентные связи с другими атомами углерода и с атомами водорода. В результате образуются насыщенные углеводороды (алканы), у которых все валентности атомов углерода насыщены.
Алканы (метановые углеводороды, СnН2n+2) представляют собой газообразные, жидкие или твердые вещества. Газообразные соединения содержат в цепи от 1 до 4 атомов углерода и входят в состав попутных и природных газов (метан, этан, пропан, бутан,изобутан).
Соединения, содержащее от 5 до 15 атомов углерода, представляют собой жидкие вещества. Начиная с гексодекана (С16Н34), нормальные алканы являются твердыми веществами, которые при обычной температуре могут находиться в растворенном или кристаллическом состоянии в нефти и в высококипящих фракциях при её перегонке.
Распределяются алканы по фракциям нефти неравномерно. Они концентрируются главным образом в нефтяных газах и низкокипящих фракциях (бензине, керосине). В масляных высококипящих фракциях их содержание резко падает.
Алканы при обычных температурах вследствие насыщенности и малополярного характера связей химически инертны, не вступают в реакции присоединения, не реагируют с щелочами и кислотами. При сравнительно высоких температурах алканы вступают в реакции замещения атома водорода на атомы галогена, нитро- и сульфогруппу:
СН4+С12 СН3С1+НС1;
NO2
СН3 - СН - СН3 + НО - ΝΟ2 СН3 - С - СН3 + H2O
CH3 СН3
При высокой температуре алканы окисляются, при этом могут идти:
а) реакции полного окисления (сгорания) до углекислого газа и воды, что происходит, например, в двигателях внутреннего сгорания.
б) реакции неполного окисления, что широко используется в химической технологии, т.к. с их помощью получают спирты, альдегиды, кислоты и другие продукты неполного окисления.
В реакциях термического разложения (крекинг) происходит расщепление алканов на углеводороды с меньшей молекулярной массой, обычно на олефин и низший алкан.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 764; Нарушение авторских прав?; Мы поможем в написании вашей работы!