
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Разбавленная азотная кислота восстанавливается малоактивными
|
|
|
|
металлами до соединений азота N+2(NO), активными металлами может
быть восстановлена до N+12O и N02; достаточно разбавленная кислота
восстанавливается до соединений азота N-3(NH4NO3) по следующим схемам:
Сu+НNОз 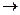 Сu(NОз)2+NO+H2O
Сu(NОз)2+NO+H2O
Zn+HNO3 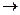 Zn(NO3)2+N2+H2O Са + НNОз
Zn(NO3)2+N2+H2O Са + НNОз 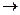 Са(NОз)2 + NH4NO3 + H2O
Са(NОз)2 + NH4NO3 + H2O
Аu, Pt, Ir, Rh, Nb, Та, W и др. азотная кислота не окисляет. Чистое железо, алюминий и хром на холоду концентрированной НNОз не окисляются, а пассивируются, т.е. на поверхности образуются оксидные пленки.
Следует отметить, что ряд напряжений металлов характеризует восстановительную способность их ионов только в водных растворах.
По величине электродного потенциала можно судить лишь о принципиальной (термодинамической) возможности растворения или осаждения металла, о направлении окислительно-восстановительной реакции.
Однако, ряд напряжений металлов нельзя рассматривать как абсолютную характеристику свойств металлов, действительную во всех случаях и при всех условиях.
СВОЙСТВА МЕТАЛЛОВ
С ВАЛЕНТНЫМИ S-ЭЛЕКТРОНАМИ
К типичным металлам относятся s-элементы, расположенные в главных подгруппах I-II групп периодической системы.
Атомы всех щелочных металлов (I группа: Li, Na, K, Rb, Cs) имеют валентную электронную конфигурацию s¹. Радиусы атомов щелочных металлов монотонно возрастают, а потенциалы ионизации убывают в направлении Li – Fr. Щелочные металлы обладают наибольшей реакционной способностью среди всех металлов и никогда не встречаются в природе в металлическом состоянии. Степень окисления щелочных металлов во всех соединениях +1. Щелочные металлы непосредственно соединяются с кислородом (Э2О), галогенами (ЭГ), серой (Э2S), с водородом (ЭН), водой (ЭОН) и др. Все соединения щелочных металлов ионные.
Слабые металлические связи объясняют низкие температуры плавления и кипения щелочных металлов, их мягкость, ковкость и пластичность.
Важнейшее соединение натрия – хлорид натрия NaCl (поваренная соль) - широко используется в быту и как сырье для получения кальцинированной (Na2CO3), питьевой (NaHCO3) и каустической (NaOH) соды, а также хлора и других продуктов.
Практический интерес представляют пероксиды натрия и калия (Ме2О2), используемые для регенерации кислорода в подводных лодках и в изолирующих противогазах:
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
Из общего количества получаемых калийных соединений около 90 % употребляют в качестве удобрений.
Рубидий и цезий используются для изготовления фотоэлементов.
Металлы главной подгруппы II группы - Be, Mg, Ca, Sr, Ba и Ra. Ca, Sr, Ba и Ra называют щелочноземельными, т.к. их гидроксиды Ме(ОН)2 обладают щелочными свойствами, а их оксиды МеО по своей тугоплавкости сходны с оксидами тяжелых металлов, называвшихся раньше землями. На внешнем уровне атомов этих элементов – по два спаренных s-электрона, которые при возбуждении атомов разъединяются (s¹p¹), при этом проявляется свойственная для элемента второй группы валентность, равная двум и степень окисления +2.
Для перевода s-электрона в р-подуровень требуется энергия, поэтому щелочноземельные металлы менее активны, чем щелочные металлы, их ионизационные потенциалы выше, радиусы атомов меньше, чем у щелочных металлов, они значительно более тугоплавкие, твердые, менее легкие по сравнению со щелочными металлами.
При комнатной температуре Ве и Mg на воздухе довольно устойчивы, т.к. оксидная пленка, образующаяся на их поверхности, защищает металлы от дальнейшего окисления. Остальные металлы этой группы активно окисляются кислородом воздуха. При высокой температуре все щелочноземельные металлы взаимодействуют с серой, водородом, азотом и др.
Все соединения этих металлов (за исключением некоторых соединений Ве) являются ионными. Все оксиды и гидроксиды этих элементов (за исключением бериллия) обладают основными свойствами.
Бериллий заметно отличается по свойствам от других элементов данной группы, проявляя много неметаллических свойств, например, амфотерный характер гидроксида:
Ве(ОН)2 + 2КОН = К2[Ве(ОН)4]
Ве(ОН)2 + 2НСl = ВеСl2 + 2Н2О
Бериллий используют как добавку при производстве сплавов, в ядерных реакторах; ВеО (tпл° = 2550°С) применяется при производстве огнеупорных материалов.
Магний – важнейшая часть легких сплавов, обладающих хорошими механическими и антикоррозийными свойствами, не магнитных и не искрящих при ударах и трении. Эти сплавы нашли применение в самолетостроении и в производстве наземного транспорта.
MgO – жженая магнезия (tпл° = 2800°С) – применяется для получения огнеупорных материалов (шамот), и для получения магнезиального цемента (смесь MgO и MgCl2), из которого изготавливают легкие звуконепроницаемые строительные детали и конструкции.
Кальций используют в качестве восстановителя оксидов редких металлов, а также для получения твердых сплавов со свинцом.
СаСО3 – карбонат кальция – главная составная часть известняка, мела, мрамора.
СаSO4 – сульфат кальция - широко используется для штукатурных работ (СаSO4 · 0,5Н2О – алебастр).
Са3(РО4)2 – фосфат кальция – основной компонент фосфоритов и апатитов, является сырьем для производства фосфорных удобрений.
СВОЙСТВА ЭЛЕМЕНТОВ С ВАЛЕНТНЫМИ
Р - ЭЛЕКТРОНАМИ
Если свойства s-металлов характеризуются плавным изменением свойств в пределах каждой группы, а свойства d-металлов также плавно изменяются в пределах каждого ряда, то начиная с III А группы наблюдаются резкие изменения свойств элементов в каждой группе от типично металлических к типично неметаллическим. С увеличением числа электронов на внешнем уровне атомов уменьшается восстановительная способность атомов и усиливается их окислительная активность (увеличивается электроотрицательность, сродство к электрону, энергия ионизации элементов). В группах периодической системы сверху вниз у р-элементов усиливаются восстановительные свойства.
Элементы главной подгруппы III группы – алюминий, галлий, индий, таллий - являются р-элементами с электронной структурой внешнего электронного уровня s²р¹. При возбуждении один из s-электронов переходит на р-подуровень. Поэтому для них характерно трехвалентное состояние, а для таллия также и одновалентное. Al, Ga, In, Tl – серебристо-белые, сравнительно мягкие и пластичные металлы, сходные по своим химическим свойствам. На воздухе все они покрываются плотной оксидной пленкой. Оксиды и гидроксиды алюминия, галлия, индия амфотерны, а оксиды таллия - Tl2О, Tl2О3 – характеризуются только основными свойствами.
Al не растворяется в концентрированной азотной кислоте, Al и In хорошо растворяются в растворе щелочи:
2Al + 6КОН + 6Н2О = 3Н2 + 2К3[Al(ОН)6]
гексагидроксоалюминат калия
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 628; Нарушение авторских прав?; Мы поможем в написании вашей работы!