
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие в гетерогенных системах, произведение растворимости
|
|
|
|
Ионное произведение воды. Водородный показатель
Вода – очень слабый амфотерный электролит: Н20  Н+ + ОН‾ при 24°С=1,6∙10‾9
Н+ + ОН‾ при 24°С=1,6∙10‾9
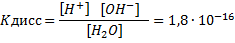
Подставляя в уравнение Кдисс [Н2O]=[Н+]∙[0Н-] концентрацию воды, которая вычисляется из соотношения [Н2O] =1000/18 = 55,5 моль/л, получаем выражение для константы воды: 1,8∙10-16∙55,5 = [Н+]∙[0Н-] = 1∙10-14=КН2О,
где КН2О=1∙10-14 - ионное произведение воды; КН2О зависит от температуры, с повышением температуры КН2О увеличивается, т.е. диссоциация Н20 происходит с поглощением тепла.
КН2О – постоянна не только для Н2О, но и для разбавленных водных растворов любых веществ [Н+]=[0Н-]=√КН2О=10-7моль/л.
Пользуясь КН2О, можно выразить любую реакцию среды через концентрацию ионов водорода. Нейтральный раствор [Н+]=[0Н-]=10-7моль/л. Кислый раствор [Н+]>10-7моль/л. Щелочной раствор [Н+]<10-7моль/л.
Количественное обозначение реакции среды можно упростить, если ввести водородный показатель pH и гидроксильный показатель pОH, тогда
pH= -lg[Н+]; pОH= -lg[0Н-]. Нейтральная среда pH=7; pОH=7. Кислая средаpH<7; pОH>7. Щелочная среда pH> 7; pОH<7.
Примером гетерогенной системы может служить насыщенный раствор
труднорастворимого соединения, находящегося в равновесии с твердой фазой. К труднорастворимым веществам относятся многие электролиты - соли, основания (чаще всего амфотерные), некоторые кислоты
(H2SiO3; β-H2SnO3 и др.). Так, труднорастворимы галогениды
серебра, сульфаты бария и стронция, карбонаты бария и кальция. Сульфиды металлов, за исключением сульфидов натрия и аммония,
характеризуются очень малой растворимостью. Вследствие малой растворимости раствор труднорастворимого электролита становится насыщенным при очень малых концентрациях растворенного вещества.
Между твердой фазой и раствором электролита устанавливается равновесие, например, AgCl  Ag++CI-
Ag++CI-
твердая насыщенный
фаза раствор
В единицу времени в насыщенный раствор переходит столько ионов, сколько их вновь переходит в осадок. Это состояние равновесия характеризуется величиной константы равновесия
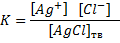
Концентрация твердой фазы – величина постоянная, т.е. [AgCl]тв= const, следовательно, [Ag+][Cl-] также величина постоянная, называемая произведением растворимости (ПР): ПРAgCI=[Ag+]∙[CI-].
Таким образом, в насыщенном растворе труднорастворимого соединения произведение концентраций его ионов при данной температуре
есть величина постоянная. При написании ПР необходимо учитывать
стехиометрические коэффициенты в уравнении диссоциации соединения, например: ПРAg2CrO4=[Ag+]2[CrO42-]; ПРAg3PO4=[Ag+]3[PO43-];: ПРAg2S3=[Ag+]2[S2-]3.
В общем виде для системы КmAn↔mkn+ nAn, ПР выразится следующим образом: ПРKmAn=[Kn+]m[Am-]n.
Из понятия ПР вытекает условие образования и растворения осадков. Если [Kn+]m[Am-]n= ПРKmAn, система находится в равновесии.
Если [Kn+]m [Am-]n>ПРKmAn или [Kn+]m [Am-]n<ПРKmAn, система стремится к новому состоянии равновесия, приводящему в первом случав к выпадению осадка, во втором - к его растворению. Эти процессы будут происходить до
тех пор, пока не будут достигнуты ионные концентрации, соответствующие величине произведения растворимости. В таблице 4 приведены
примеры некоторых труднорастворимых веществ.
Таблица 4
Произведение растворимости некоторых труднорастворимых веществ
| Вещество | ПР | Вещество | ПР |
| CuS | 6,3∙10-36 | α- ZnS | 1,6∙10-24 |
| Cu2S | 25∙10-48 | β - ZnS | 2,5∙10-22 |
| HgS | 3∙10-52 | ZnSe | 1∙10-21 |
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 555; Нарушение авторских прав?; Мы поможем в написании вашей работы!