
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень диссоциации различных электролитов
|
|
|
|
Растворы электролитов
Соли, кислоты, основания в водном растворе диссоциируют, образуя ионы противоположных зарядов. Вследствие этого растворы проводят электрический ток и называются электролитами. Таким образом, электролит – раствор, содержащий ионы; если же при растворении вещества не происходит диссоциации молекул, такие вещества называются неэлектролитами.
Количественной характеристикой электролитической диссоциации
является степень диссоциации α.
α.= Сдисс/Собщ – отношение концентрации молекул, распавшихся на ионы, к общей концентрации молекул. Если α=0, раствор неэлектролита, если α=1, молекулы электролита полностью распались на ионы.
По величине α электролиты можно условно разделить на сильные, средние и слабые. Для сильных электролитов α.>0,3 (>30%); для средних α.= 0,03 - 0,3 (2–30% ), для слабых α.<0,03 (<30 %) (табл. 3).
Таблица 3
(при См= 1 моль/литр, =25 ºС)
| Электролит | α, % | Электролит | α, % | Электролит | α, % |
| HNOз | 82,0 | Н3РО4 | 29,0 | НСN | 0,01 |
| HCl | 78,4 | Н2SеО4 | 20,0 | NН4ОН | 1,4 |
| H2SO2 | 58,0 | HF | 8,0 | Н2S | 0,07 |
| КОН | 77,0 | CH2COOH | 1,36 | ||
| NaОН | 73,0 | Н2СО3 | 0,17 |
Концентрация ионов в растворе электролита зависит от молярной концентрации См, степени диссоциации α и числа ионов данного вида ni, на которое распадается молекула электролита.
Сионов=См∙αni. Например, для раствора Н2SO4 0,5 моль/л при α=50% концентрация ионов водорода [Н+]=0,5∙0,5∙2 моль/л.
Все соли, за исключением HgCl2 и Fe(CHS)3 – сильные электролиты.
Сильные и слабые электролиты имеют свои особенности.
При растворении слабых электролитов в воде происходит обратимая диссоциация, например, для СН3СООН имеет место равновесие:
СН3СООН 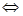 Н+ +СН3СОО‾, т.е. процесс обратим.
Н+ +СН3СОО‾, т.е. процесс обратим.
Для обратимого равновесного процесса можно применить закон действующих масс. Константа равновесия в данном случае называется константой диссоциации:
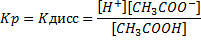
Константа диссоциации характеризует способность слабого электролита к распаду на ионы. Чем меньше величина Кдисс, тем слабее электролит. Например,
КСН3СООН = 1,82∙10-5, КНСN= 7,2∙10‾ ¹º, КНСN<КСН3СООН, т.е. НСN – более слабая кислота.
Обратимая диссоциация происходит в растворе слабого основания, например
NН4ОН 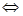 NН4+ + ОН‾;
NН4+ + ОН‾;
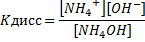
Кдисс = 1,76∙10-5, т.е. NН4ОН – слабое основание.
Если электролит диссоциирует по ступеням, то каждая ступень характеризуется своей константой диссоциации:
Н3РО4 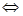 Н++Н2РО4 КI=7,6∙10-3
Н++Н2РО4 КI=7,6∙10-3
Н2РО4 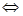 Н++НРО4 К2=6,2∙10-8
Н++НРО4 К2=6,2∙10-8
НРО4 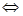 Н++РО4‾ К3=4,4∙10-13 КI>К2>К3.
Н++РО4‾ К3=4,4∙10-13 КI>К2>К3.
Диссоциация в основном идёт по первой ступени, по третьей ступени на электролит практически не диссоциирует, о чём свидетельствует малая величина К3.
Удобнее пользоваться не величинами Кдисс, а величинами рК – показателями кислоты и основания:
pКкислоты = -lgКкислоты, рКоснования =-lgКоснования.
Для Н3Р04: рК1=2,12; рК2= 7,21; рК3= 12,26.
Для характеристики свойств амфотерных электролитов необходимо знать величины констант диссоциации по кислотному и основному типам. По соотношению величин этих констант можно судить о преобладании тех или иных свойств у амфотерного электролита.
Напомним, что диссоциация амфотерного электролита проходит по
следующему уравнению (запись в общем виде):
R++ ОНֿ 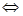 ROH
ROH 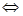 H+ROֿ.
H+ROֿ.
Тогда для Ве(0Н)2, например, равновесие диссоциации имеет вид:
Ве²++ 2OHֿ 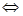 Ве(OН)2
Ве(OН)2 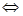 H2BeO2
H2BeO2 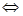 2H+Be22-;
2H+Be22-;
константа диссоциации по основному типу:
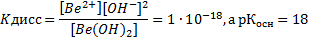
по кислотному типу
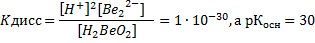
Поскольку Коск>Ккисл, у Ве(ОН)2 преобладают основные свойства.
В случае А1(0Н)3 Косн = 8 ∙10-25, Ккисл = 4∙10-13, следовательно, у А1(OН)3 преобладают кислотные свойства.
Примером электролита, у которого основные и кислотные свойства выражены примерно одинаково, может служить Ga(OH)3, у которого Ккисл=2∙10-12.
Константа диссоциации зависит от природы вещества и температуры, но не зависит от концентрации, поэтому она дает более общую
характеристику электролита, чем α.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 574; Нарушение авторских прав?; Мы поможем в написании вашей работы!