
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Произведение растворимости. Примеры решения задач
Гетерогенное равновесие "осадок ↔ насыщенный раствор" подчиняется правилу произведения растворимости, если малорастворимый
электролит диссоциирует по уравнению AmBn 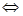 [А+]m - [B-]n. Отсюда вытекают два следствия:
[А+]m - [B-]n. Отсюда вытекают два следствия:
1. Условие растворения осадка. Произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, должно быть меньше величины произведения растворимости:[А+]m[B-]n<ПР (AmBn).
2. Условие осаждения осадка. Произведение концентраций ионов,
возведенных в степень их стехиометрических коэффициентов, должно
быть больше величины произведения растворимости: [А+]m[B-]n>Пр(AmBn).
Пример 1. Определение условий выпадения осадка. Образуется ли осадок СаСО3 при смешивании равных объемов 0,02 М растворов хлористого кальция и углекислого натрия? (Пр(СаСО3) = 1,0∙10-3)
Решение: При смешении равных объемов растворов CaCI2 и Na2CO3 объем смеси увеличивается в 2 раза, а концентрация каждого из ионов уменьшается в 2 раза. Следовательно,
[CaCI2]= [Ca+2] = 0,02∙0,5=1∙10-2 моль∙л-1.
[Na2CO3] = [CО32-] = 0,2∙0,5 = 1∙10-2 моль∙л-1.
Откуда [Ca+2]∙[CО32-]= 1∙10-2 ∙1∙10-2 = 1∙10-4. Осадок образуется, так как 1,0∙10-3< 1∙10-4.
Пример 2. Вычисление концентрации ионов малорастворимого электролита в его насыщенном растворе.
Произведение растворимости BaF2 при 18ºС равно 1,7∙106. Рассчитайте концентрацию ионов Ba+2 и F- в насыщенном растворе BaF2 при этой температуре.
Решение: BaF2 диссоциирует по уравнению BaF2 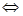 Ba+2 + 2F-. При диссоциации BaF2 ионов F-1 получается в 2 раза больше, чем ионов Ba+2. Следовательно, [F-1] = 2[Ва+2]. Произведение растворимости соли ПР(BaF2)=[Ва+2]∙[F+]. Выразим концентрацию ионов Ва+2, тогда
Ba+2 + 2F-. При диссоциации BaF2 ионов F-1 получается в 2 раза больше, чем ионов Ba+2. Следовательно, [F-1] = 2[Ва+2]. Произведение растворимости соли ПР(BaF2)=[Ва+2]∙[F+]. Выразим концентрацию ионов Ва+2, тогда
ПР (BaF2) = [Ва+2] ∙ 2∙ [Ва+2]2 = 4[Ва+2]3= 1,7∙10-6
Концентрация ионов [Ва+2] равна: [Ва+2]= √1,7∙10-6 / 4 = 0,75∙10-2 моль∙л-1;
Концентрация ионов F-1 равна: [F-1]=0,75∙10-2∙2=1,5∙10-2 моль∙л-1;
Пример 3. Вычисление произведения растворимости малорастворимого электролита.
Растворимость Ag3PO4 в воде при 20ºС равна 0,0065 г∙л-1. Рассчитайте значение произведения растворимости.
Решение. Растворимость Ag3PO4 в моль∙л-1 равна:
Р=6,5∙10-3/418,58 = 1,6∙10-5 моль∙л-1.
При диссоциации 1 моль Ag3PO4 образует 3 моль ионов Ag+. 1 моль ионов PO43-, поэтому концентрация ионов PO43- равна растворимости Ag3PO4, а концентрация иона Ag+ в 3 раза больше, т.е.
С[PO43-] =1,6∙10-5моль∙л-1. [Ag+]= 3∙1,6∙10-5.
Произведение растворимости Ag3PO4 равно:
ПР=[Ag+]3 + [PO43-]= (4,8∙10-5)3∙1,6∙10-5= 110,6 ∙10-15∙1,6∙10-3= 1,77∙10-18.
Пример 4. Определение условий одновременного выпадения осадков солей из раствора.
При каком соотношении концентрации ионов Zn+2Cd+2 в растворе прибавление к нему раствора Na2CO3 вызывает одновременное осаждение карбонатов этих ионов? ПР(ZnCOз)= 6∙10-11
Решение. Концентрацию вводимых карбонат-ионов обозначим через
[СО32- ], тогда
[Zn+2]=ПР(ZnCOз) / С(СО32-), [Cd+2] = ПР (CdСОз)/[СО32- ].
[Zn+2]/[Cd+2] = ПР(ZnCOз)/ПР (CdСОз)=6∙10-11/2,5∙10-14=2,4∙103=2400
Карбонаты цинка и кадмия будут выпадать одновременно из раствора, если [Zn+2] >[Cd+2] в 2400 раз. Если отношение [Zn+2] /[Cd+2] > 2400, то первым из раствора будет выпадать ZnCO3, до тех пор, пока отношение [Zn+2] /[Cd+2] не будет равным 2400. И только после этого начнется одновременное выпадение осадков. Если же отношение концентрации ионов цинка и кадмия меньше 2400, то первым начнет осаждаться карбонат кадмия. Осаждение карбоната кадмия будет протекать до тех пор, пока отношение [Zn+2] /[Cd+2] не достигнет значения, при котором ZnCOз и CdСОз будут осаждаться одновременно.
Пример 5. Вычисление растворимости электролита по величине
произведения растворимости.
Произведение растворимости ПР оксалата бария ВаС2О4 равно
1,62∙10-1. Вычислите растворимость ВаС2О4 в воде.
Решение. В растворе труднорастворимого сильного электролита
ВаС2О4 существует равновесие: ВаС2О4= Ва+2 + (С2О42-).
ПрВаС2О4= [Ва+2] ∙ [С2О42-]
в осадке в растворе
Так как оксалат бария диссоциирует на два иона, то его концентрация в растворе равна концентрации каждого из ионов, т.е.
[ВаС2О4] = [Ва+2] = [С2О42-] = √1,62∙10-7 = 0,4∙10-3моль-л-1,
т.е. растворимость оксалата бария в воде при t =20°С равна 0,4∙10-3моль-л-1.
|
|
Дата добавления: 2014-11-16; Просмотров: 1324; Нарушение авторских прав?; Мы поможем в написании вашей работы!