
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия. Кристаллическое состояние веществ — одно из самых распространенных в окружающей нас природе
|
|
|
|
КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ
Кристаллическое состояние веществ — одно из самых распространенных в окружающей нас природе. Кристаллическими являются очень многие синтетические материалы, используемые в современной технике: полупроводники, ферромагнетики, сверхпрочные и жаростойкие сплавы. В связи с этим изучение кристаллического состояния является делом первостепенной научной важности.
Каковы основные признаки кристаллического состояния? Твердое вещество существует в двух формах: оно может быть кристаллическим или аморфным. Одно из характерных свойств кристаллического вещества, в отличие от аморфного, — это способность самоограняться. Кристаллы образуются по-разному: они выпадают в осадок при упаривании раствора, возникают при охлаждении расплава, при достаточно низкой температуре, они растут из паров (иней или морозные узоры на стекле). И во всех этих случаях на поверхности кристаллов самопроизвольно возникают плоские грани.
Вместе с тем, огранка — хотя и характерный, но не обязательный признак кристаллического вещества. В некоторых случаях грани кристаллов бывают выражены весьма нечетко. Иногда вещество состоит из таких мелких кристалликов, что грани трудно обнаружить даже под микроскопом. Кроме того, если кристалл обточить, придав ему округлую форму, лишенную граней, вещество не перестанет быть кристаллическим и свойства его останутся прежними.
Способность самоограняться — это лишь одно из проявлений более общего, наиболее важного качества кристаллов — их анизотропии (различие свойств по разным направлениям).
Если из кристалла поваренной соли, имеющего форму куба, выточить шар, а затем погрузить его в насыщенный раствор соли и медленно упаривать раствор, то кристалл начнет расти и постепенно снова примет форму куба. Этот опыт показывает, что скорость роста кристалла в разных направлениях неодинакова. Грани кристалла возникают перпендикулярно направлениям, по которым скорость роста минимальна.
Анизотропия проявляется в очень многих физических свойствах кристаллов. В отличие от кристаллических, аморфные вещества, имеющие совершенно одинаковые свойства по всем направлениям, называют изотропными. В этом отношении они подобны жидкостям и газам.
Еще одна характерная особенность кристаллов — фиксированная температура плавления. При нагревании кристаллическое вещество до определенной температуры остается твердым, а затем начинает плавиться, переходя в жидкое состояние. Пока продолжается плавление, температура не повышается. Аморфные вещества ведут себя иначе. При нагревании куска стекла он начинает постепенно размягчаться и, наконец, растекается, принимая форму сосуда. Невозможно установить, при какой температуре это произошло. Вязкость стекла уменьшается постепенно, никакой остановки в росте температуры нет.
Но самая важная особенность кристаллического вещества заключается в упорядоченном расположении его атомов.
На рисунке 2 показано внутреннее строение кристалла (а) и аморфного вещества (б) того же состава.
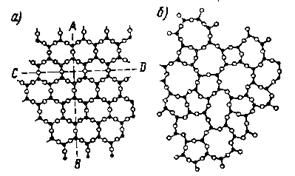
Рис 2. Внутренне строение кристаллического вещества
Рисунок имеет условный характер, так как в действительности атомы вещества располагаются не на плоскости, а в пространстве. Рассмотрим атомы, обозначенные черными точками. В обоих случаях окружение каждого из таких атомов почти одинаково: ближайшие соседи располагаются по вершинам треугольника, совершенно правильного при кристаллическом и почти правильного при аморфном состоянии. Значит, и в аморфном веществе имеется так называемый «ближний порядок». Но если принять во внимание не только самых близких соседей, то выяснится, что в кристалле окружение каждого атома остается одинаковым, а в аморфном веществе оно окажется разным. Поэтому говорят, что в кристаллическом теле, в отличие от аморфного, наблюдается «дальний» порядок. Следствием этого являются все особые свойства кристаллов. Естественно, что в направлении АВ, параллельном направлению некоторых связей между атомами, свойства будут не такими, как в направлении CD, вдоль которого такие связи не проходят. В аморфном веществе подобных специфических направлений мы не найдем. Так объясняется анизотропия кристаллов, в частности различная скорость роста в различных направлениях, а следовательно, и способность самоограняться.
В приведенном примере мы рассматривали вещество, которое может существовать и в аморфном и в кристаллическом состоянии. Это действительно так. При быстром охлаждении расплавленного сахара получается аморфная масса (леденец), при медленном охлаждении в образующемся твердом сахаре можно заметить поблескивающие кристаллики.
Нетрудно понять, почему так происходит. Представим себе роту солдат, которым приказано строиться. Если им дать для этого хотя бы немного времени, они успеют занять свои места, выровнять ряды. Если же после команды «строиться» будет сразу подана команда «стой», то расположение солдат так и останется беспорядочным, хотя, может быть, и наметится какая-то тенденция к порядку. Нечто подобное происходит и при затвердевании: если процесс идет медленно, частицы успевают занять отведенные им места, быстрое затвердевание не дает им такой возможности.
Но даже в твердом аморфном веществе, хотя и очень медленно, атомы перемещаются и постепенно упорядочивают свое расположение. Леденец, пролежав несколько месяцев, начинает кристаллизоваться «засахариваться». Старинное стекло иногда мутнеет — в нем образуется множество мельчайших кристалликов и возникающая неоднородность материала приводит к потере прозрачности.
Аморфное вещество самопроизвольно переходит в кристаллическое, а вот противоположный процесс никогда не наблюдается. Отсюда следует очень важный вывод: кристаллическое состояние — это равновесное, наиболее устойчивое состояние твердого вещества.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 454; Нарушение авторских прав?; Мы поможем в написании вашей работы!