
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электро-механическое сопряжение в сердечной мышце
|
|
|
|
Вход внеклеточного Са2+ запускает освобождение Са2+ из саркоплазматического ретикулума, инициируя, тем самым, сокращение кардиомиоцитов. Длительность мышечного сокращения определяется временем, в течение которого концентрация Са2+ остается повышенной. Механизм, с помощью которого процесс возбуждения преобразуется в процесс увеличения [Са]i, назвали электромеханическим сопряжением.
Деполяризация плазматической мембраны кардиомиоцитов желудочков распространяется по Т-трубочкам, расположенным поперек продольной оси миоцитов. В кардиомиоцитах есть также аксиальные Т-трубочки, расположенные параллельно продольной оси и соединяющие поперечные трубочки между собой. T-трубочки имеют четкую организацию и проникают в мышцу в каждом саркомере в двух местах - там, где соединяются А и I полоски. Каждая Т-трубочка соединена с двумя цистернами саркоплазматического ретикулума. Саркоплазматический ретикулум - это органелла, которая содержит запасы внутриклеточного Са2+. Т-трубочка вместе с двумя цистернами называется триадой, и эта система играет решающую роль в сопряжении процессов возбуждения и сокращения в сердечной мышце. Деполяризация мембраны Т-трубочки вызывает освобождение Са2+ из саркоплазматического ретикулума.
Потенциал действия, возникая вследствие деполяризации, распространяется по мембране Т-трубочки. Деполяризация мембраны Т-трубочки активирует L-тип Са2+-каналов (L-происходит от long duration – т.е. каналы имеющие медленную кинетику работы), которые организованы в кластеры из четырех каналов, поэтому их называют тетрадами (рис. 2.15.). Эти потенциал-зависимые каналы играют главную роль в сопряжении электрического возбуждения и сокращения, так как являются сенсорами потенциала. Каждый из четырех Са2+-каналов в тетраде называют дигидропиридиновыми рецепторами (DHP), так как они чувствительны к дигидропиридинам (digydropyridines), относящимися к классу антигипертензивных препаратов. Деполяризация мембраны Т-трубочек приводит к конформационным изменениям каждого из четырех Са2+-каналов L-типа, что вызывает два эффекта. Во-первых, через четыре канальные поры в саркоплазму входит Са2+. Во-вторых, что гораздо более важно, конформационные изменения в каждой из четырех субъединиц другого канала - Са2+-освобождающего канала в мембране саркоплазматического ретикулума. Са2+-освобождающий канал саркоплазматического ретикулума имеет гомотетрамерную структуру, отличающуюся от таковой L-типа Са2+-канала. Са2+-освобождающий канал саркоплазматического ретикулума известен еще как рианодиновый рецептор, т.к. он чувствителен к рианодину и кофеину, которые принадлежат к классу растительных алкалоидов.
По мере того, как L-тип Са2+-канала мембраны Т-трубочки открывает Са2+-освобождающий канал мембраны саркоплазматического ретикулума, запасенные в нем ионы Са2+ покидают цистерны саркоплазматического ретикулума, что приводит к быстрому увеличению [Са2+]i. Ионы Са2+ активируют тропонин С и инициируют цикл образования поперечных мостиков. Таким образом, процесс электро-механического сопряжения охватывает период от деполяризации Т-трубочек до начала цикла образования поперечных мостиков.

Рис. 2. 12. Структура тонких и толстых филаментов

Рис. 2.13. Роль Са 2+ в запуске сокращения мышцы
В сердечной мышце вход Са2+ через L-тип Са2+-каналов является крайне важным для увеличения [Ca2+]i в непосредственной близости от рианодиновых рецепторов саркоплазматического ретикулума. Этот триггерный Са2+ активирует соседние кластеры рианодиновых рецепторов и побуждает их к еще большему освобождению Са2+ в цитоплазму (так называемое вызванное Са2+ освобождение Са2+). Поэтому, если сердце поместить в бескальциевый раствор, оно сразу прекратит сокращаться. Отдельный эпизод Са2+-вызванного освобождения Са2+ обеспечивает значительное, но локальное увеличение [Са2+]i, так называемый Са2+ спарк (spark - вспышка). Его можно увидеть под конфокальным микроскопом при добавлении Са2+-чувствительного красителя. При одновременном открытии большого количества L-типа Са2+-каналов в сердечной мышце возникает множество Са2+ спарков, что приводит к глобальному увеличению [Са2+]i.

Рис. 2.14. Схема движения ионов кальция при электро-механическом сопряжении в сердечной мышце. Потенциал действия запускает поступление кальция из внеклеточной среды, затем Са2+ вызывает освобождение Са2+ из внутриклеточного депо - саркоплазматического ретикулума. Свободный кальций саркоплазмы активирует сокращение миофиламентов (систола). Расслабление (диастола) наступает в результате захвата Са2+ в саркоплазматический ретикулум, вытеснения внутриклеточного кальция Na+/Са2+-обменником и Са2+ насосом сарколеммы.
2.4.2. Механизм сокращения сердечной мышцы
В сердечной мышце сокращение запускается увеличением внутриклеточной концентрации Са2+ - [Са2+]i, что позволяет поддерживать циклический процесс образования поперечных мостиков. При возбуждении концентрация Са2+ в саркоплазме может повышаться от 10-7 М (уровень в покое) до 10-5 М.
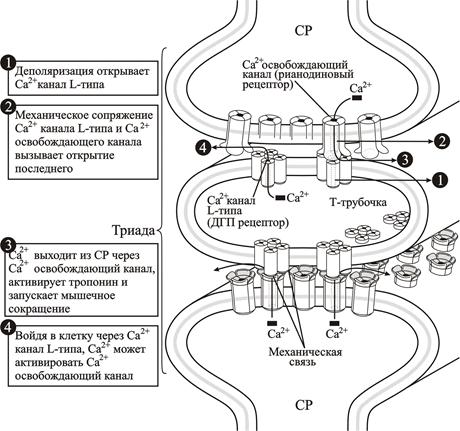
Рис. 2.15. Электро-механическое сопряжение в скелетной мышце
Затем концентрация Са2+ начинает снижаться, что является сигналом к прекращению цикла образования поперечных мостиков и мышца начинает расслабляться
Необходимо подчеркнуть, что Са2+ управляет сокращением через регуляторные белки, а не через прямое взаимодействие с сократительными белками. В отсутствие Са2+ эти регуляторные белки блокируют взаимодействие актина и миозина и тормозят сокращение. Связывание Са2+ с этими белками приводит к конформационным изменениям регуляторного комплекса белков, которые устраняют их блокирующее действие.
Сократительные белки превращают энергию гидролиза АТФ в механическую энергию. Процесс циклического образования поперечных мостиков (рис. 2.16.) можно разделить на 5 этапов. Вначале головка миозина прикрепляется к нити актина за счет выделения кинетической энергии от предыдущего цикла и после того, как актомиозиновый комплекс освободит аденозиндифосфат (АДФ). В отсутствие АТФ система будет находиться в “ригидном” состоянии неопределенно долго. В стадии ригидности головка миозина располагается под углом 45о по отношению к нитям актина и миозина.
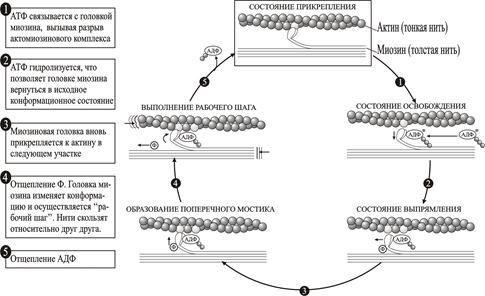
Рис. 2.16. Цикл образования поперечных мостиков в сердечной мышце.
Этап 1. Связывание АТФ. Связывание АТФ с тяжелой цепью головки миозина уменьшает сродство миозина к актину, что вызывает отсоединение миозина от нити актина. Если все поперечные мостики в мышце находятся в таком состоянии - мышца полностью расслаблена.
Этап 2. Гидролиз АТФ. Расщепление АТФ на АДФ и неорганический фосфат (Ф) происходит в головке миозина, продукты гидролиза остаются в миозине. В результате гидролиза головка миозина “распрямляется”, т.е. располагается перпендикулярно или под углом 900 относительно толстых и тонких нитей. Это движение приводит к тому, что кончик нити миозина продвигается на 11 нм вдоль нити актина и головка миозина оказывается против нового мономера актина. Если все поперечные мостики находятся в таком состоянии - мышца расслаблена.
Этап 3. Образование поперечного мостика. Выпрямленная головка миозина вновь связывается уже с другим фрагментом нити актина. Это связывание объясняется повышением сродства комплекса миозин-АДФ-фосфат к актину.
Этап 4. Отсоединение неорганического фосфата от миозина. Отсоединение фосфата от головки миозина обеспечивает конформационное изменение головки, в результате которого головка миозина изгибается под углом 450 и проталкивает нить актина на расстояние 11 нм в направлении к хвостовой части нити миозина. Таким образом, нить актина продвигается вдоль миозина, вызывая укорочение мышцы.
Этап 5. Диссоциация АДФ. Отсоединение АДФ от миозина завершает цикл и актомиозиновый комплекс приходит в ригидное состояние. Головка миозина остается в положении под углом 450 по отношению к толстым и тонким филаментам. Без АДФ миозиновый комплекс остается связанным с актином до тех пор, пока не присоединит другую молекулу АТФ.
На каждый цикл образования поперечного мостика расходуется одна молекула АТФ. Следовательно, мышца должна ресинтезировать АТФ из АДФ по мере расходования АТФ. Наиболее доступный источник для ресинтеза АТФ - это фосфокреатин и гликоген. Сердечная мышца практически не отдыхает, поэтому в кардиомиоцитах очень большая плотность митохондрий, что обеспечивает поддержание высокого уровня окислительного фосфорилирования (синтеза АТФ).
В результате циклического образования и разрушения поперечных мостиков тонкие нити скользят между толстыми и мышца укорачивается.
Расслабление сердечной мышцы, то есть расхождение сократительных белков, определяется тремя процессами: 1) выводом Са2+ во внеклеточную жидкость, 2) повторным захватом Са2+ из саркоплазмы в саркоплазматический ретикулум и 3) отщеплением Са2+ от комплекса Са2+/тропонин.
Выведение Са2+ во внеклеточную жидкость. Как и в большинстве других клеток, удаление Са2+ из кардиомиоцитов происходит двумя путями (рис. 2.14): 1) с помощью имеющегося в сарколемме Na+/Cа2+ обменника, который активируется при высоком уровне [Cа2+]i и 2) с помощью Са2+ насоса поверхностной мембраны, который работает даже при низких уровнях [Cа2+]i. Даже во время плато ПД из кардиомиоцитов выводится некоторое количество ионов Са2+. После возвращения мембранного потенциала к исходному, более негативному, уровню, процесс выведения Са2+ достигает своего высшего уровня и [Cа2+]i уменьшается. При стабильном состоянии (например, после нескольких ПД) весь Са2+, поступающий в саркоплазму через L-тип Са2+-каналов, должен быть удален.
Обратный захват Са2+ в саркоплазматический ретикулум. Даже во время плато ПД некоторое количество Са2+, накопившегося в цитоплазме, поступает в саркоплазматический ретикулум с помощью Са2+-насоса. Важным регулятором активности Са2+-насоса в сердечной мышце является фосфоламбан - интегральный белок мембраны саркоплазматического ретикулума, имеющий один трансмембранный сегмент. В мембранах саркоплазматического ретикулума сердечной, гладкомышечной и медленно сокращающейся скелетной мышцы фосфоламбан представляет собой пентамер, способный функционировать и как ионный канал и как регулятор Cа2+-каналов. Расщепление пентамера приводит к образованию мономеров фосфоламбана, гидрофильный цитоплазматический домен которых способен ингибировать Са2+-насос. Однако, фосфорилирование фосфоламбана любой из известных киназ устраняет ингибирующее действие фосфоламбана на Са2+-насос, что ускоряет поступление Са2+ в саркоплазматический ретикулум. В конечном итоге, это приводит к увеличению скорости расслабления сердечной мышцы. Поэтому неудивительно, что у нокаутных мышей с дефицитом фосфоламбана, Са2+-насос не ингибируется и скорость расслабления мышцы увеличивается.
Фосфорилирование фосфоламбана протеинкиназой А хорошо объясняет тот факт, что агонисты b1-адренергических рецепторов (например, адреналин, действующий через протеинкиназу А), ускоряют расслабление сердечной мышцы.
Удаление Са2+ от тропонина С. По мере того, как [Ca]i падает, ионы Са2+ отщепляются от тропонина, что прекращает взаимодействие актина и миозина и мышца расслабляется. b1-адренергические агонисты ускоряют расслабление посредством фосфорилирования тропонина I, что, в свою очередь, увеличивает скорость отщепления Са2+ от тропонина С.
Агенты, вызывающие положительные инотропные эффекты, повышают сократимость миокарда посредством увеличения [Ca 2+]i. Вещества, непосредственно влияющие на сократимость миокарда, могут изменять динамику сокращения сердца независимо от пред- и пост-нагрузки (см. главу 3.2). Такие вещества или факторы обладают одной общей способностью - изменять концентрацию внутриклеточного кальция - [Cа2+]i. Если какой-либо фактор увеличивает сократимость миокарда - его называют положительным инотропным агентом, если уменьшает сократимость - отрицательным инотропным агентом.
Агенты, вызывающие положительные инотропные эффекты. Факторы, которые усиливают сокращение миокарда посредством увеличения [Cа2+]i, действуют двумя путями - либо открывают Са2+-каналы, блокируя Na-Са обмен, либо блокируют Са2+ насос плазматической мембраны.
1. Адренергические агонисты. Катехоламины (например, адреналин и норадреналин) действуют на b1-адренорецепторы, активируя a-субъединицу Gs-типа гетеротримерного G-белка. Активирование a-субъединицы приводит к двум эффектам. Во-первых, увеличивается уровень циклического аденозинмонофосфата (цАМФ) и стимулируется протенкиназа А, что вызывает усиление сокращения и увеличение скорости расслабления миокарда (табл. 2.3.). Во-вторых, происходит открытие L-типа Са2+-каналов плазматической мембраны, т.е. увеличивается вход Са2+ во время прохождения ПД, увеличивается [Са2+ ]i и сократимость усиливается.
2. Сердечные гликозиды. Производные дигиталиса способны ингибировать Na-K насос плазматической мембраны и, следовательно, повышать уровень внутриклеточного Na+ ([Na+]i). В результате происходит замедление Na-Са обмена, повышение уровня [Са2+ ]i и увеличение сократимости. Недавние исследования выявили новый механизм действия сердечных гликозидов - через увеличение проницаемости Na+-каналов плазматической мембраны для ионов Са2+.
3. Высокая концентрация внеклеточного Са2+. Повышенная концентрация внеклеточного Са2+ [Са2+]o увеличивает [Са2+]i и, следовательно, усиливает сокращение миокарда, двумя путями. Во-первых, она снижает уровень обмена внеклеточного Na+ на внутриклеточный Са2+. Во-вторых, в этих условиях, при прохождении ПД, в кардиомиоциты поступает больше ионов Са2+ через L-тип Са2+-каналов.
4. Низкая концентрация внеклеточного Na+. Уменьшение градиента Na+ понижает уровень Na-Са обмена, что приводит к увеличению [Са2+]i и, как следствие, к усилению сокращения миокарда.
5. Увеличенная частота сердцебиений. При повышении частоты сердечных сокращений, увеличиваются запасы Са2+ в саркоплазматическом ретикулуме, что приводит к увеличению [Ca]i и к усилению сокращений.
Отрицательные инотропные агенты. Все факторы, которые уменьшают силу сокращения миокарда, снижают внутриклеточную концентрацию Са2+.
1. Блокаторы Са2+-каналов. Ингибиторы L-типа Са2+-каналов, такие как верапамил, дилтиазем и нифедипин - уменьшают количество Са2+, входящего в кардиомиоциты во время плато ПД. Таким образом, снижение [Са2+]i приводит к ослаблению сокращения сердца.
2. Низкая концентрация внеклеточного Са2+. Снижение [Са2+]о понижает, в свою очередь, [Са2+]i с помощью двух механизмов - или увеличивая выведение Са2+ через Na-Са обменник, или уменьшая вход Са2+ через L-тип Са2+-каналов во время плато ПД.
3. Высокая концентрация внеклеточного Na+. Повышенное содержание внеклеточного Na+ ([Na+]о) повышает уровень Na-Са обмена, понижая, тем самым, [Са2+]i.
|
|
|
|
|
Дата добавления: 2014-11-08; Просмотров: 4645; Нарушение авторских прав?; Мы поможем в написании вашей работы!